Валентность химических металлов - это способность атома металла образовывать химические связи с другими атомами. Она играет важную роль в понимании свойств и реактивности металлов, а также в определении их возможностей в различных химических реакциях. Таблица валентности химических металлов позволяет систематизировать и организовать информацию о валентности различных металлов, что облегчает изучение химических свойств и реакций данных элементов.
Валентность металлов определяется особыми химическими свойствами каждого элемента и его электронной конфигурацией. Зная валентность металлов, возможно предсказать типы химических связей, которые они могут образовывать, а также их склонность к окислению или восстановлению. В таблице валентности химических металлов можно найти информацию о валентности различных металлов, их примерных электронных конфигурациях и основных свойствах.
Таблица валентности химических металлов является полезным инструментом для химиков и исследователей, позволяющим легче и быстрее ориентироваться в химических свойствах и реактивности металлов. Знание валентности металлов помогает понять, какие реакции возможны с участием данных элементов, и какие их химические свойства можно использовать в различных технологических и научных областях.
Металлы с однозначной валентностью
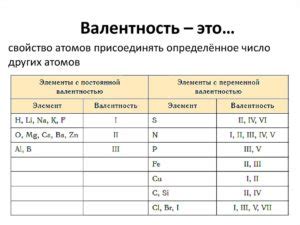
Металлы с однозначной валентностью - это элементы, у которых в химических соединениях металлический ион всегда имеет одну и ту же зарядность. Это облегчает прогнозирование и понимание их химической активности и реакционной способности.
Некоторые из самых распространенных металлов с однозначной валентностью включают щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и рубидий (Rb). Эти металлы имеют однозначную валентность +1 и образуют соединения с анионами, чтобы достичь стабильности.
Еще одним примером металла с однозначной валентностью является серебро (Ag). Серебро образует соединения с одной зарядностью +1 и характеризуется высокой химической активностью. Оно используется в различных промышленных процессах и реакциях.
Однозначная валентность этих металлов также связана с их положением в периодической таблице элементов. Щелочные металлы расположены в первой группе, а серебро относится к группе переходных металлов.
Металлы с многозначной валентностью
Многозначная валентность является основным свойством некоторых химических металлов. Это означает, что данные элементы имеют возможность образовывать соединения с разным числом электронов во внешней оболочке.
Одним из примеров металлов с многозначной валентностью является железо. У него могут быть две основные степени окисления: Fe2+ и Fe3+. Это связано с тем, что кислород в соединениях с Fe может принимать две, а иногда три электроотрицательные частицы.
Второй пример - марганец. Он также может образовывать две главные степени окисления: Mn2+ и Mn4+. У марганца показатели валентности зависят от особенностей окружающей среды и условий реакций.
Однако стоит отметить, что даже металлы с многозначной валентностью могут образовывать соединения с другими степенями окисления, если имеются соответствующие условия. При этом эти элементы проявляют разные свойства и могут участвовать в различных химических реакциях.
Роль валентности в химических реакциях
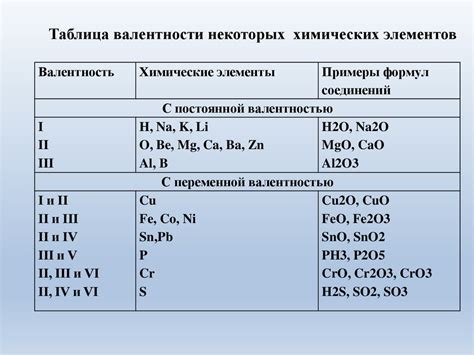
Валентность – это количество электронов, которые атом может отдать или принять, чтобы достичь электронной конфигурации с полностью заполненной оболочкой. В химических реакциях валентность играет ключевую роль, определяя способность атомов образовывать химические связи и обмениваться электронами.
Валентность металлов оказывает влияние на их реакционную активность и способность образовывать соединения с другими элементами. Металлы с низкой валентностью (например, валентность +1) обычно обладают большей активностью и более легко образуют ионы и соединения с элементами, имеющими отрицательную валентность. Например, натрий с валентностью +1 легко формирует ион Na+, который связывается с анионами хлора, Cl-, образуя хлорид натрия (NaCl).
С другой стороны, металлы с более высокой валентностью (например, +2 или +3) имеют более сложную электронную структуру и часто образуют комплексные соединения с различными лигандами. Например, железо с валентностью +2 может образовывать разнообразные соединения в соли железа, такие как сульфат железа (FeSO4) или хлорид железа(II) (FeCl2).
Знание валентности металлов позволяет предсказывать и объяснять их химические свойства и поведение в химических реакциях. Валентность также определяет степень окисления металла в соединениях, что очень важно для анализа и понимания реакций окисления-восстановления и молекулярного строения соединений.
Вопрос-ответ

Как определить валентность химического металла?
Валентность химического металла можно определить, исходя из его места в таблице валентности. Обычно она указывается рядом с названием химического элемента. Например, если металл находится во 2-м периоде таблицы, то его валентность будет равна 2.
Какие свойства химических металлов связаны с их валентностью?
Свойства химических металлов, такие как физическая и химическая реактивность, способность образовывать соединения и соединяться с другими элементами, напрямую связаны с их валентностью. Например, металлы с высокой валентностью обычно имеют большую склонность к образованию соединений.
Какие металлы относятся к переходным?
К переходным металлам относятся элементы с атомными номерами от 21 до 30, от 39 до 48, от 57 до 80 и от 89 до 112. Они обладают специфическими свойствами, включая различную валентность и способность образовывать сплавы.
Как валентность влияет на реактивность металлов?
Валентность металла оказывает существенное влияние на его химическую реактивность. Металлы с низкой валентностью чаще всего обладают меньшей активностью, чем металлы с высокой валентностью. Высокая валентность обусловливает возможность металла образовывать стабильные соединения с другими элементами.
Какая валентность у металлов группы 3?
Металлы группы 3 имеют валентность 3. Это, например, хром (Cr), железо (Fe), алюминий (Al) и другие. Данные металлы могут образовывать соединения с валентностью 3 и иметь химическую реактивность, соответствующую этой валентности.
