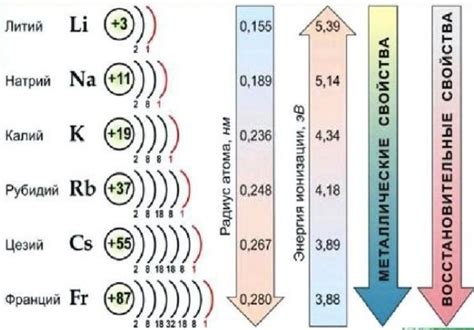
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), являются группой элементов периодической таблицы, имеющих сходные химические свойства. Они относятся к первой группе (1A) периодической системы и находятся в одной вертикали снизу вверх под водородом (H). Щелочные металлы являются самыми реактивными из всех металлов и очень активно взаимодействуют с водой и кислородом.
Щелочные металлы обладают рядом общих свойств. Они имеют малую плотность и низкую температуру плавления и кипения. Их синие цвета ярко выражены, что связано с их электронной структурой. Щелочные металлы имеют низкую твердость и могут быть нарезаны ножом. Они обладают низкой удельной теплоемкостью и хорошей теплопроводностью.
Соединения щелочных металлов широко применяются в различных областях, включая промышленность, медицину и научные исследования. Ключевым соединением каждого щелочного металла является гидрооксид - гидроксид лития (LiOH), гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид рубидия (RbOH) и гидроксид цезия (CsOH). Эти соединения образуют сильные щелочные растворы и широко используются в химической промышленности.
В заключение, щелочные металлы - это группа химических элементов, которые обладают сходными свойствами и являются наиболее реактивными металлами. Их соединения находят широкое применение в различных сферах их промышленности. Познание свойств и возможностей щелочных металлов является важным для развития технологий и науки.
Химическая таблица с соединениями щелочных металлов
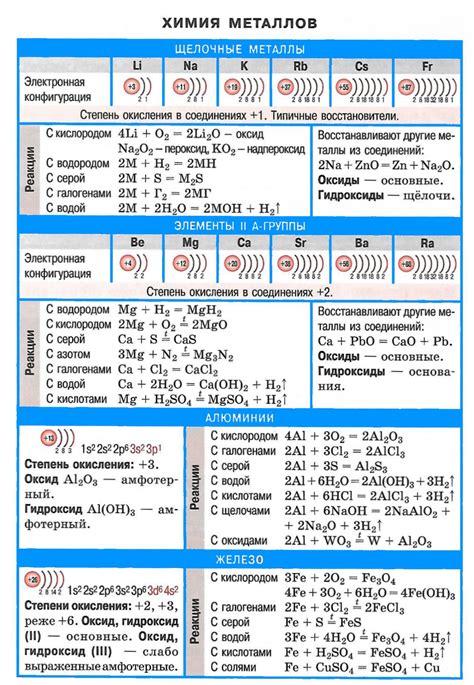
Щелочные металлы - это группа элементов, которая находится в первой группе периодической системы. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают высокой химической реактивностью и образуют различные соединения, которые можно найти в химической таблице.
На химической таблице можно увидеть различные соединения щелочных металлов с другими элементами. Например, щелочные металлы образуют хлориды, бромиды и йодиды. Хлориды щелочных металлов имеют общую формулу MCl, где M - щелочный металл. Натрий образует натрий хлорид (NaCl), калий - калий хлорид (KCl) и так далее.
Кроме того, щелочные металлы образуют оксиды, которые также можно найти в химической таблице. Например, литий образует литий оксид (Li2O), натрий - натрий оксид (Na2O) и так далее. Оксиды щелочных металлов широко используются в промышленности, например, в производстве стекла.
Химическая таблица с соединениями щелочных металлов помогает исследователям и студентам лучше понять свойства и химические реакции этих элементов. Она позволяет увидеть закономерности в образовании соединений и предсказывать их свойства. Химическая таблица является важным инструментом в химических исследованиях и помогает расширить наши знания о ми ВЕЩЕСТВА.
Свойства соединений щелочных металлов
Соединения щелочных металлов, таких как натрий, калий и литий, обладают рядом химических и физических свойств, которые делают их полезными и важными в различных областях промышленности и научных исследований.
Одно из главных свойств соединений щелочных металлов - их растворимость в воде. Это связано с тем, что эти металлы обладают высокой электроотрицательностью и способностью образовывать ионы водорода при реакции с водой. Растворимость соединений щелочных металлов также зависит от их структуры и размеров ионов, а также от электростатических взаимодействий.
Другое важное свойство соединений щелочных металлов - их высокая теплоемкость. Это означает, что они обладают способностью поглощать большое количество тепла при нагревании или выделять тепло при охлаждении. Из-за этого свойства щелочные металлы и их соединения часто используются в процессах нагревания и охлаждения, например, в производстве стекла и керамики.
Соединения щелочных металлов также обладают высокой электропроводностью. Это связано с тем, что их ионы могут легко перемещаться в растворе или в твердом состоянии. Из-за этого свойства щелочные металлы и их соединения используются в производстве батарей, электродов и других электротехнических устройствах.
Кроме того, соединения щелочных металлов обладают хорошей солевой химией и способностью образовывать стабильные и кристаллические структуры. Это позволяет использовать их в процессах химического синтеза и производства различных химических соединений.
Таким образом, свойства соединений щелочных металлов делают их важными компонентами многих отраслей промышленности и научных исследований, и их использование продолжает развиваться и расширяться.
Вопрос-ответ

От чего зависит свойство соединений щелочных металлов?
Свойства соединений щелочных металлов зависят от типа органического аниона и количества зарядов, которые присутствуют в анионе. Например, карбонаты и гидроксиды щелочных металлов обладают щелочной реакцией, а хлориды щелочных металлов - кислой реакцией.
Какие соединения видны в химической таблице щелочных металлов?
В химической таблице щелочных металлов видны основные соединения: нитраты (NO3-), сульфаты (SO4-), карбонаты (CO3-), гидрофосфаты (HPO4-), гидроксиды (OH-), хлориды (Cl-).
Какие свойства имеют щелочные металлы?
Щелочные металлы обладают рядом характерных свойств: они мягкие и легкоплавкие, образуют ионы с положительной однозначной зарядностью, обладают низкой электроотрицательностью, хорошо взаимодействуют с водой, образуя гидроксиды, и реакционоспособны с кислородом, серой, галогенами и некоторыми неокисляющими или слабокислыми неорганическими кислотами.
Какие соединения щелочных металлов можно использовать в быту?
Соединения щелочных металлов широко используются в быту. Например, гидроксид натрия (NaOH) используется для очистки и дезинфекции, гидроксид калия (KOH) используется в косметической промышленности и для производства мыла, а бикарбонат натрия (NaHCO3) - в качестве разрыхлителя в выпечке.
