В химии существуют различные взаимодействия между веществами, и одно из наиболее известных и изученных - это взаимодействие кислот с металлами. Кислоты - это вещества, которые способны отдавать протоны, а металлы - элементы, обладающие благородством и электродожской активностью.
Взаимодействие кислот с металлами заключается в том, что кислота атакует поверхность металла, образуя новые соединения. При этом могут выделяться газы, и происходить физические и химические реакции. Важно отметить, что различные кислоты могут взаимодействовать с металлами по-разному. Это связано с их свойствами и степенью активности.
Для удобства систематизации взаимодействия кислот с металлами была разработана специальная таблица. Таблица взаимодействия кислот с металлами отражает степень реакции между кислотами и металлами. В ней перечислены различные кислоты и металлы, а также указана степень активности каждого элемента в данной реакции.
Важность таблицы взаимодействия кислот с металлами
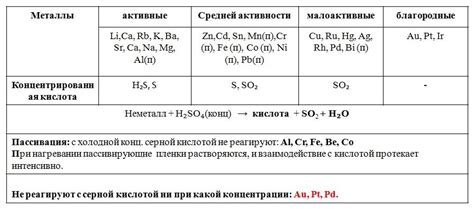
Таблица взаимодействия кислот с металлами является важным инструментом для химических исследований и промышленных процессов. Она содержит информацию о том, какие кислоты реагируют с различными металлами и какие вещества образуются в результате этих реакций.
Эта таблица позволяет определить, какие кислоты могут быть использованы для удаления окиси, ржавчины или других загрязнений с поверхности металлических изделий. Она помогает выбрать оптимальные условия обработки, такие как концентрация кислоты и время воздействия, чтобы достичь наилучших результатов.
Также таблица взаимодействия кислот с металлами используется при разработке новых материалов и сплавов. Она помогает предсказать, какие металлы могут быть использованы в сочетании с определенными кислотами для получения желаемых свойств материала, таких как прочность, эластичность или устойчивость к коррозии. Это позволяет сэкономить время и ресурсы при разработке новых материалов.
Кроме того, таблица взаимодействия кислот с металлами полезна для безопасности и правильного обращения с химическими веществами. Она указывает на опасность реакции между определенными кислотами и металлами, которая может привести к выделению газов, пожару или взрыву. Это помогает предупредить возможные аварии и принять соответствующие меры предосторожности при работе с определенными сочетаниями кислот и металлов.
Таким образом, таблица взаимодействия кислот с металлами играет важную роль в различных областях науки и промышленности. Она помогает оптимизировать процессы обработки металлических изделий, способствует разработке новых материалов и обеспечивает безопасность при работе с химическими веществами.
Основные моменты и применение

Таблица взаимодействия кислот с металлами является важным справочным материалом для изучения реакций между кислотами и металлами. Она содержит информацию о возможных реакциях, продуктах реакции, условиях ее протекания и соответствующих уравнениях.
Данная таблица помогает представить связь между типом кислоты и ее химическим свойством, а также выявить влияние металлов на реакционные способности кислот. В таблице представлены основные кислоты (содержащие ионы водорода), такие как соляная, серная, азотная, фосфорная и другие, а также различные металлы.
Таблица позволяет определить, какой металл реагирует с определенной кислотой и какие продукты образуются в результате реакции. Например, она помогает понять, что соляная кислота реагирует с металлами, превышающими водород в активности (например, цинк, железо) и образует соли с соответствующими ионами металла и водородный газ. Эта информация полезна в химической промышленности, при изучении свойств материалов и процессов разложения веществ.
Также таблица позволяет оценить степень активности металла, его реакционную способность и предсказать результаты реакций. Например, по таблице видно, что ионы металлов, расположенные выше в таблице, склонны реагировать с кислотами более активно, образуя соответствующие соли и выделяя водородный газ. Этим свойством металлов могут пользоваться в различных процессах, например, при получении водорода или при кислой очистке поверхности металла.
Свойства кислот и металлов:

Кислоты – это химические вещества, которые в растворе образуют положительные ионные формы водорода. Они могут обладать серьезным агрессивным поведением при взаимодействии с различными материалами.
Свойства кислот:
- Кислоты имеют кислотный вкус и обладают способностью менять цвет индикаторов.
- Они обладают высокой электропроводностью в растворе.
- Кислоты обычно реагируют с металлами, они могут выделяться водородные газы и образовывать соли.
Металлы – это группа химических элементов, которые характеризуются блеском, хорошей проводимостью тепла и электричества, а также способностью образовывать положительные ионы.
Свойства металлов:
- Металлы обладают высокой теплопроводностью и электропроводностью.
- Они обычно имеют металлический блеск и высокую пластичность, что позволяет им быть подверженными формованию.
- Металлы могут быть реактивными и способными образовывать ионы в растворах или солях при взаимодействии с кислотами.
Взаимодействие кислот с металлами является важным аспектом химии и может приводить к различным химическим реакциям, таким как образование солей и выделение водородного газа. Понимание свойств кислот и металлов помогает в дальнейшем изучении химических процессов и развитию различных технологий.
Роли и особенности взаимодействия

Взаимодействие кислот с металлами имеет множество ролей и проявляет различные особенности в зависимости от конкретной пары кислоты и металла.
Роль кислоты: Кислоты взаимодействуют с металлами как активные агенты. Они обладают протонной функцией и способны отдавать протоны металлам, изменяя свою структуру. Это позволяет кислоте вступать в реакцию с металлами и образовывать новые соединения.
Роль металла: Металлы, в свою очередь, выступают взаимодействующими компонентами для кислот. Они активно вступают во взаимодействие с протонами кислоты и образуют ионы металла. Это вызывает изменение свойств металла и приводит к образованию новых соединений с кислотой.
Особенности взаимодействия: При взаимодействии кислоты с металлом происходят ряд характерных особенностей. Во-первых, часто возникает активное поглощение кислоты металлом, что свидетельствует о стабильности образовавшегося соединения. Во-вторых, взаимодействие может сопровождаться выделением газа, шипением или изменением цвета реакционной смеси. В-третьих, некоторые металлы проявляют поверхностные реакции, в результате которых образуются сложные структуры или оксидные пленки на поверхности металла.
Изучение роли и особенностей взаимодействия кислот с металлами позволяет понять, как образуются различные соединения и как изменяются свойства материалов в процессе химических реакций.
Таблица взаимодействия кислот с металлами
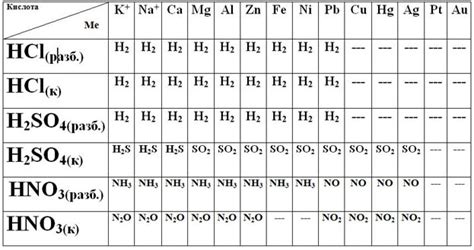
Взаимодействие кислот с металлами – это химическая реакция, при которой металл растворяется в растворе кислоты с образованием соли и выделением водорода.
Интенсивность данной реакции зависит от химической активности металла и концентрации кислоты. Взаимодействие кислот с металлами является важным явлением в химии и имеет множество практических применений.
В таблице ниже приведены некоторые примеры взаимодействия различных кислот с металлами:
| Металл | Кислота | Соль | Выделяющийся газ |
|---|---|---|---|
| Цинк | Соляная кислота (HCl) | Хлорид цинка (ZnCl2) | Водород (H2) |
| Железо | Серная кислота (H2SO4) | Сульфат железа (FeSO4) | Сернистый газ (SO2) |
| Медь | Азотная кислота (HNO3) | Нитрат меди (Cu(NO3)2) | Оксид азота (NO) |
| Алюминий | Фосфорная кислота (H3PO4) | Фосфат алюминия (AlPO4) | Фосфористый газ (PH3) |
Таблица взаимодействия кислот с металлами помогает понять, какие металлы могут быть использованы в определенной химической реакции и какие соли будут образовываться в результате.
Вопрос-ответ

Какие кислоты можно использовать для растворения металлов?
Для растворения различных металлов можно использовать разные кислоты. Например, соляная кислота (HCl) обычно используется для растворения металлов, таких как железо (Fe) и цинк (Zn), тогда как азотная кислота (HNO3) может использоваться для растворения меди (Cu) и свинца (Pb). Также можно использовать серную кислоту (H2SO4) для растворения металлов, таких как алюминий (Al) и цинк (Zn).
Какой тип реакции происходит при взаимодействии кислоты с металлом?
Взаимодействие кислоты с металлом обычно приводит к реакции, известной как окислительно-восстановительная реакция. В этой реакции кислота отдает протон или протоны (H+) металлу, который в свою очередь отдает электроны (e-), образуя ион металла и высвобождая водород (H2). Такая реакция можно представить следующим уравнением: HCl + Fe → FeCl2 + H2.
Каким образом таблица взаимодействия кислот с металлами может быть полезна?
Таблица взаимодействия кислот с металлами представляет собой удобный инструмент, который помогает определить, какая кислота может быть использована для растворения конкретного металла. Она позволяет сравнивать реактивность различных кислот и металлов, а также определить, какие сочетания кислот и металлов образуют стабильные соединения. Такая информация может быть полезна в химических исследованиях, промышленности и образовании.
