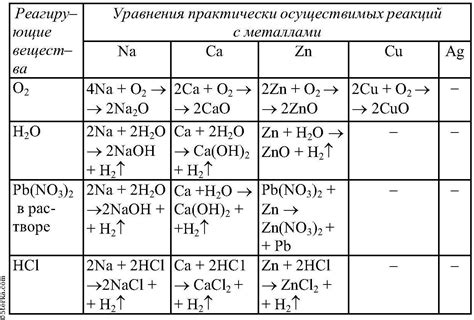
Химия 9 класса изучает основные химические свойства и реакции металлов. Металлы являются важными элементами в природе и имеют широкое применение в нашей жизни. Они обладают различными химическими свойствами и способностью реагировать с различными веществами.
В данной статье представлена таблица практически осуществимых реакций металлов с реагирующими веществами, которая поможет лучше понять и запомнить основные химические свойства металлов. В таблице указаны названия металлов и реагирующих веществ, а также результаты их взаимодействия.
Например, реакция металла натрия с водой является одной из самых известных и демонстрационных в химии. При этом образуется гидроксид натрия и выделяется водородный газ. Алюминий реагирует с кислородом, образуя оксид алюминия, который можно использовать для получения металла. Железо реагирует с серной кислотой, образуя сульфат железа и выделяя сернистый газ.
Таблица реакций металлов с реагирующими веществами позволяет получить представление о том, какие металлы реагируют с кислотами, щелочами, водой и другими веществами. Знание таких реакций позволяет прогнозировать, как металл будет вести себя в реальных условиях и использовать его в различных процессах и технологиях.
Изучение таблицы практически осуществимых реакций металлов с реагирующими веществами поможет учащимся лучше понять принципы взаимодействия металлов с другими веществами и их использование в различных областях жизни, таких как металлургия, химическая промышленность, энергетика и другие.
Таблица практически осуществимых реакций металлов в химии 9 класса
В химии 9 класса ученики изучают различные реакции металлов с реагирующими веществами, что помогает им понять химическую активность различных металлов. Реакции металлов с кислотами являются наиболее интересными и релевантными для учебной программы. Они позволяют учащимся наблюдать, как различные металлы различно реагируют с кислотами и выявлять зависимость химической активности металлов от их положения в ряду напряжения. Вот несколько примеров реакций металлов с кислотами:
- Реакция алюминия с соляной кислотой: при добавлении металла в кислоту наблюдается выделение пузырьков газа и образование соли алюминия, AlCl3. Это реакция иллюстрирует химическую активность алюминия и его способность разрушить молекулу кислоты.
- Реакция цинка с серной кислотой: при добавлении цинка в кислоту наблюдается выделение пузырьков газа и образование соли цинка, ZnSO4. Эта реакция также позволяет ученикам наблюдать химическую активность цинка и его способность разрушить молекулу кислоты.
- Реакция железа с соляной кислотой: при добавлении железа в кислоту наблюдается выделение пузырьков газа и образование соли железа, FeCl2 или FeCl3. Эта реакция демонстрирует, что химическая активность железа зависит от его окислительного состояния, что объясняется его способностью менять степень окисления.
Кроме реакций металлов с кислотами, ученики также изучают реакции металлов с водой и солями. Например, реакция кальция с водой приводит к образованию гидроксида кальция и выделению водорода:
Ca + 2H2O -> Ca(OH)2 + H2
Эта реакция показывает, что химическая активность кальция позволяет ему реагировать с водой, образуя осадок и газ.
Также, ученики изучают реакции металлов с солями, например, реакцию цинка с раствором медного(II) сернокислого раствора:
Zn + CuSO4 -> ZnSO4 + Cu
Эта реакция демонстрирует, что цинк может вытеснить медь из раствора соли, так как цинк более активен химически, чем медь.
Такие реакции металлов привлекают внимание учеников и помогают им понять базовые принципы химической активности металлов.
Металлы активнее водорода
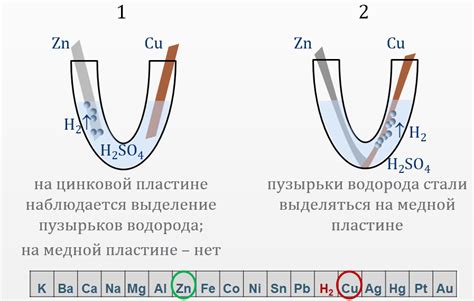
В химии металлы делят на активные и пассивные. Активные металлы обладают высокой реакционной способностью и способны не только образовывать оксиды, но и образовывать соли с кислотами. Одним из показателей активности металлов является их способность вытеснять водород из воды или кислот.
Металлы активнее водорода реагируют с водой и дисплейся в виде пузырьков водорода. Например, натрий и калий очень активные металлы и реагируют с водой моментально, при этом выделяется большое количество водорода. Медь и серебро, напротив, пассивные металлы и реагируют с водой очень медленно.
Список металлов, отсортированных по их активности относительно водорода, можно представить в виде таблицы. Наиболее активные металлы располагаются вверху таблицы, а пассивные - внизу. Из этой таблицы можно увидеть, что литий, натрий, калий и кальций являются крайне активными и реагируют с водой с образованием пузырьков водорода. Золото, платина и другие пассивные металлы не реагируют с водой.
Малоактивные металлы
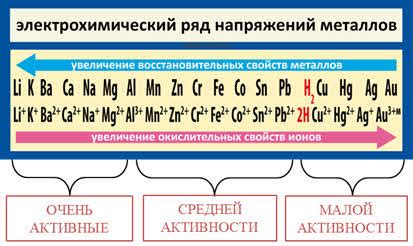
Малоактивные металлы - это группа химических элементов, которые имеют малую способность к реакциям с другими веществами. Они не обладают достаточной активностью для образования стабильных соединений с реагирующими веществами.
Одним из примеров малоактивного металла является серебро. Серебро позиционируется в таблице активности металлов довольно низко и в большинстве случаев не проявляет активности при обычных условиях. Оно не реагирует с водой, нитратами или серной кислотой.
Еще одним примером малоактивного металла является золото. Золото известно своей стабильностью и высокой устойчивостью к окружающей среде. Оно не реагирует с большинством кислот и щелочей, что делает его неподверженным коррозии.
Также к малоактивным металлам относится платина. Платина очень устойчива к химическим реакциям и не подвержена окислению или коррозии. Она не реагирует с кислотами или щелочами, что делает ее одним из самых стабильных и надежных металлов.
Малоактивные металлы обладают высокой устойчивостью к окружающей среде и не подвержены химическому разложению. Их использование оправдано в различных отраслях промышленности, включая электронику, медицину и ювелирное дело.
Реакции щелочных и щелочноземельных металлов

Щелочные и щелочноземельные металлы – это элементы, расположенные в первых двух группах периодической системы химических элементов. Они характеризуются высокой электроотрицательностью и способностью образовывать простые и сложные ионы с положительным зарядом. Реакции этих металлов с различными реагирующими веществами изучаются в химии в рамках программы 9 класса.
Щелочные металлы, такие как литий, натрий и калий, реагируют с водой. При этом образуется гидроксид металла и высвобождается водород. Реакция проходит с выделением тепла. Например, реакция натрия с водой происходит по следующему уравнению:
2Na + 2H2O → 2NaOH + H2
Щелочноземельные металлы, такие как магний, кальций и барий, также реагируют с водой, но в данном случае реакция протекает менее интенсивно, чем у щелочных металлов.
Щелочные и щелочноземельные металлы также реагируют с кислотами, образуя соли и высвобождая водород. Реакция щелочных металлов с соляной кислотой протекает по следующему уравнению:
2Na + 2HCl → 2NaCl + H2
Реакция щелочноземельных металлов с соляной кислотой аналогична:
Mg + 2HCl → MgCl2 + H2
Также щелочные и щелочноземельные металлы реагируют с кислородом, выделяя при этом соответствующие оксиды. Например, реакция магния с кислородом можно описать следующим уравнением:
2Mg + O2 → 2MgO
Реакции щелочных и щелочноземельных металлов с реагирующими веществами представляют основу для понимания принципов химических реакций и использования данных веществ в различных областях человеческой деятельности, таких как производство лекарств, удобрений и других химических соединений.
Реакции металлов с кислотами

В химии 9 класса изучаются различные реакции металлов с реагирующими веществами. Одной из таких реакций является взаимодействие металлов с кислотами. Кислоты представляют собой вещества, способные отдавать протоны (H+). При контакте с металлами эти протоны взаимодействуют с атомами металла, что приводит к образованию солей и выделению водорода (H2).
Реакции образования солей и выделения водорода имеют общую формулу: Металл + Кислота → Соль + Водород.
При этом не все металлы реагируют с кислотами одинаково. Некоторые металлы, такие как натрий, калий, магний и алюминий, образуют соли непосредственно с выделением водорода. Другие металлы, например, железо и цинк, выделяются в виде ионов, которые затем вступают в реакцию с гидроксид-ионами и образуют гидроксиды металлов, а затем соли.
Важно отметить, что реактивность металлов с кислотами увеличивается по мере движения по периодической таблице справа налево и сверху вниз. Это означает, что металлы в верхней левой части таблицы, такие как литий и калий, являются самыми реактивными и сильно реагируют с кислотами, в то время как металлы в нижней правой части, такие как медь и серебро, практически не реагируют с кислотами.
В химии 9 класса изучение реакций металлов с кислотами позволяет ученикам понять, какие металлы могут реагировать с кислотами и в каких условиях такие реакции протекают.
Реакции металлов с растворами солей

Реакции металлов с растворами солей являются одним из важных разделов химии. Они позволяют изучить активность металлов, их способность взаимодействовать с различными веществами.
Растворы солей содержат положительно заряженные ионы металлов, а также отрицательно заряженные анионы. При взаимодействии с металлами происходит обмен ионами, в результате которого образуются новые вещества.
В зависимости от активности металлов, реакции с растворами солей могут проходить с разной интенсивностью. Некоторые металлы обладают высокой активностью и способны реагировать с большинством растворов солей, а другие металлы проявляют низкую активность и могут взаимодействовать только с определенными соединениями.
Например, активные металлы, такие как натрий, калий и магний, могут реагировать с растворами солей большинства металлов, образуя новые соединения. При этом в растворе образуется осадок или происходит выделение газа.
Некоторые металлы, такие как железо и алюминий, могут реагировать только с определенными растворами солей. Например, железо реагирует с растворами солей меди и цинка, образуя новые вещества и выделяя металлы в виде осадка.
Реакции металлов с растворами солей можно представить в виде таблицы, где указаны металлы и растворы солей, с которыми они могут взаимодействовать. Это помогает систематизировать знания о реакциях и лучше понять их механизм.
Реакции металлов с растворами оснований
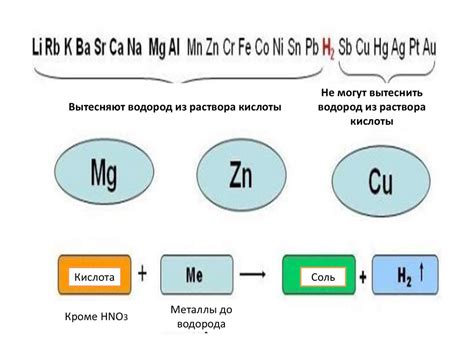
Основания являются реагирующими веществами, которые могут образовывать растворы с щелочными свойствами. Когда металлы вступают во взаимодействие с растворами оснований, происходят различные реакции.
Некоторые металлы, такие как натрий (Na), калий (K) и литий (Li), реагируют с водными растворами оснований, например, гидроксидом натрия (NaOH) или гидроксидом калия (KOH). В результате реакции образуется гидроксид металла и выделяется водород. Например, sodium 2 Na + 2 H2O → 2 NaOH + H2.
Другие металлы, такие как алюминий (Al) и цинк (Zn), могут реагировать с гидроксидами некоторых оснований с образованием соответствующих солей и выделением водорода. Например, алюминий реагирует с гидроксидом натрия по следующему уравнению: 2 Al + 2 NaOH + 6 H2O → 2 NaAl(OH)4 + 3 H2.
Однако некоторые металлы, например, медь (Cu), серебро (Ag) и золото (Au), не реагируют с растворами оснований. Они являются химически инертными и не вступают во взаимодействие с основаниями.
Реакции металлов с растворами оснований часто применяются в химических процессах, в промышленности и в повседневной жизни. Они позволяют получать различные соединения для применения в разных сферах, например, в производстве удобрений, стекла и медицинских препаратов. Кроме того, эти реакции играют важную роль в химических анализах и исследованиях.
Вопрос-ответ

Какие металлы реагируют с кислотой?
Среди металлов с кислотой реагируют алюминий, цинк, железо и некоторые другие металлы. Например, кислородистую кислоту растворяют металлы первой группы в ряду главных элементов, такие как натрий и калий.
Какие металлы реагируют с водой?
Некоторые металлы могут реагировать с водой. Например, натрий и калий реагируют с водой, образуя гидроксид металла и выделяя водород. Однако не все металлы реагируют с водой, некоторые металлы, такие как железо или свинец, не реагируют с обычной водой.
Какие металлы реагируют с кислородом?
Некоторые металлы стремятся образовать оксиды при взаимодействии с кислородом. Например, магний и алюминий реагируют с кислородом и образуют соответствующие оксиды. Однако не все металлы реагируют с кислородом. Например, золото и серебро практически не реагируют с кислородом.
Какие металлы реагируют с хлором?
Некоторые металлы реагируют с хлором, образуя хлориды металлов. Например, натрий и калий реагируют с хлором, образуя соответствующие хлориды. Однако не все металлы реагируют с хлором, некоторые металлы, такие как железо или алюминий, не реагируют с хлором при обычных условиях.
Какие металлы реагируют с серной кислотой?
Серная кислота растворяет металлы, образуя соответствующие соли. Некоторые металлы, такие как цинк, железо и алюминий, реагируют с серной кислотой при нагревании или разбавлении. Однако не все металлы реагируют с серной кислотой, некоторые металлы, такие как золото или платина, не реагируют с серной кислотой.
