Во время изучения химии в школьной программе, ученики сталкиваются с понятием растворимости металлов и таблицей активности металлов. Это важная тема, которая имеет большое значение для успешной сдачи экзамена ЕГЭ. Растворимость металлов может быть определена с использованием таблицы активности металлов, которая отражает их химическую активность.
Таблица активности металлов представляет собой список металлов в порядке их активности. Металлы в этой таблице располагаются в порядке уменьшения степени их активности. На верхней части таблицы находятся самые активные металлы, а на нижней части - наименее активные металлы. Расположение металлов в этом ряду определяет их способность образовывать ионы в растворе и проводить электрический ток.
Для экзамена ЕГЭ знание таблицы активности металлов имеет большое значение. Зная порядок активности металлов, ученики могут предсказывать результат химических реакций и определять возможность образования осадка или выделения газа при взаимодействии различных металлов с растворами солей. Также таблица активности металлов помогает понять, почему некоторые металлы растворяются в кислотах, а другие - нет.
Таблица растворимости металлов
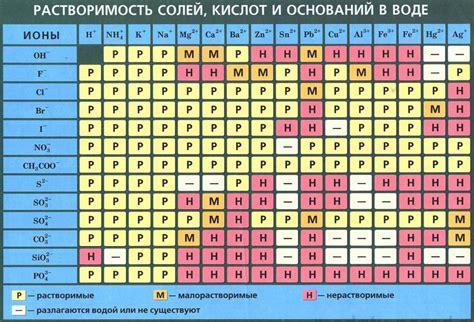
Таблица растворимости металлов является важным инструментом для химиков и студентов, изучающих химию. Она представляет собой перечень различных металлов, упорядоченных по степени их растворимости в воде или других растворителях.
Растворимость металлов в данной таблице определена как способность металла образовывать ионы в растворе. Металлы, которые растворяются легко и образуют стабильные ионы, считаются растворимыми, в то время как металлы, которые плохо растворяются или не образуют стабильные ионы, относятся к нерастворимым.
В таблице растворимости металлов приведены данные о том, какие ионы образуются в растворе для каждого металла. Например, металлы, образующие ионы двухвалентной зарядности (например, медь(II), железо(II), свинец(II) и др.), считаются более растворимыми, чем металлы, образующие ионы с низкой зарядностью (например, медь(I), железо(I), свинец(IV) и др.).
Таблица растворимости металлов часто используется для определения, какие соединения играют роль электролитов в реакциях растворения или образования отложений. Знание ряда активности металлов также позволяет предсказывать, ка
Ряд активности металлов

Ряд активности металлов - это таблица, которая отображает их химическую реакционность по отношению к воде и кислотам. В ряду активности металлы расположены по возрастанию активности: самые активные металлы находятся ближе к верху ряда, а наименее активные - книзу.
Значение ряда активности металлов для экзамена ЕГЭ заключается в том, что он позволяет предсказывать генерацию электролизера. Важно помнить, что металлы, расположенные выше в ряду активности, будут вытеснять металлы, которые находятся ниже, из своих солей.
Также, зная ряд активности металлов, можно предсказать, будет ли реакция между металлом и кислотой сопровождаться выделением водорода или нет. Металлы, расположенные выше в ряду активности, сопоставительно реагируют с кислотами, выделяя водород.
Вместе с тем, ряд активности металлов позволяет понять, какой из металлов обладает большей активностью, и, соответственно, какой из них может использоваться в качестве редуцирующего агента.
Значение для экзамена ЕГЭ

Таблица растворимости металлов и значение ряда активности играют важную роль на экзамене ЕГЭ по химии. Знание этих терминов позволяет ученикам лучше понять основные принципы химических реакций и предсказать их результаты.
С помощью таблицы растворимости металлов можно определить, будет ли данное вещество растворяться в воде или нет. Так, например, если металл находится выше в ряду активности, чем водород, он будет растворяться с образованием гидроксида и выделением водорода. И наоборот, если металл находится ниже в ряду активности, он не будет растворяться в воде.
Понимание ряда активности также помогает понять, какие металлы и их соли способны взаимодействовать и образовывать осадок в растворе. Это знание может быть использовано для проведения определений, а также для предсказания химических реакций в различных задачах, которые могут встретиться на экзамене.
Таким образом, знание таблицы растворимости металлов и ряда активности имеет важное значение для успешной подготовки к экзамену ЕГЭ по химии. Помимо того, что эти термины появляются в теоретических вопросах, они также могут быть использованы для решения практических задач и аналитических заданий, проверяющих умение применять полученные знания в реальных ситуациях.
Изучение ряда активности металлов

Ряд активности металлов является важным инструментом при изучении и анализе химических реакций. Он отражает способность металла образовывать соединения с различными кислотами или солями. Чем выше металл на ряду активности, тем более активным он является и тем легче он реагирует с другими веществами.
Значение ряда активности металлов состоит в том, что он позволяет определить возможность прохождения реакции между металлом и кислотой или солью. Если металл стоит выше в ряду активности, то он может вытеснить из раствора ион другого металла, который стоит ниже. Таким образом, ряд активности металлов позволяет предсказать, какие реакции будут происходить и какие соединения образуют металлы.
Для удобства изучения и запоминания ряда активности металлов существует таблица растворимости, которая представляет собой список металлов, упорядоченных в порядке их активности. Металлы, расположенные выше по таблице, более активны и чаще встречаются в реакциях. Металлы, стоящие ниже, менее активны и реакции с их участием происходят реже или вообще не происходят.
Определение ряда активности металлов является важным аспектом изучения химии и широко применяется в различных сферах, например, при проведении экспериментов, создании новых материалов или изучении реакций, происходящих в природе и в повседневной жизни.
Вопрос-ответ

Что такое ряд активности металлов?
Ряд активности металлов - это упорядоченный по возрастанию список металлов, расположенных по степени их активности в химических реакциях. Этот список позволяет определить растворимость металлов и их способность вытеснить друг друга из растворов и соединений.
Какие металлы находятся в верхней части ряда активности, а какие - в нижней?
Металлы, расположенные в верхней части ряда активности, являются более активными и имеют большую способность взаимодействовать с кислотами и растворами, они легче вытесняют другие металлы из их соединений. На самом верху ряда активности находятся щелочные и щелочноземельные металлы, а в нижней части располагаются металлы переходных и благородных металлов, которые являются менее активными и малорастворимыми.
