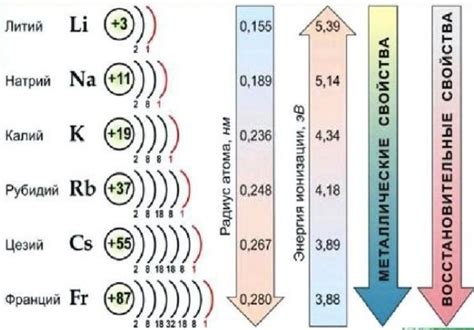
Щелочные металлы — это элементы периодической системы, находящиеся в первой группе. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом уникальных свойств, включая низкую плотность, мягкость, низкую температуру плавления и высокую реактивность.
Таблица соединений щелочных металлов представляет собой удобный и компактный способ представления основных химических формул, названий и свойств соединений, в которых присутствуют щелочные металлы. Такие соединения могут быть представлены различными формулами и названиями в зависимости от наличия и соотношения элементов в соединении.
Свойства щелочных металлов и их соединений делают их важными для различных областей науки и промышленности. Например, натрий и калий используются в пищевой промышленности как добавки, обеспечивающие сохранение вкуса и улучшение качества продуктов. Щелочные металлы также широко используются в производстве стекла, жидких металлов и литий-ионных аккумуляторов.
Формула соединений щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы элементов, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают сходными химическими свойствами, одним из которых является способность образовывать щелочные соединения с другими веществами.
Формулы соединений щелочных металлов обычно состоят из иона щелочного металла с положительным зарядом и отрицательного иона или группы ионов. Например, формула хлорида натрия – NaCl, где Na+ обозначает ион натрия, а Cl- – ион хлора. Это общая формула для всех щелочных металлов, где вместо Na указывается соответствующий ион щелочного металла.
Соединения щелочных металлов обладают определенными свойствами. Они обычно являются твердыми кристаллическими веществами, растворимыми в воде и обладающими высокой теплопроводностью. Они также обладают высокой химической активностью и образуют щелочную среду в растворе. Эти соединения служат важными ионами во многих биохимических процессах и применяются в различных областях, включая производство стекла, мыла и удобрений.
Название соединений щелочных металлов
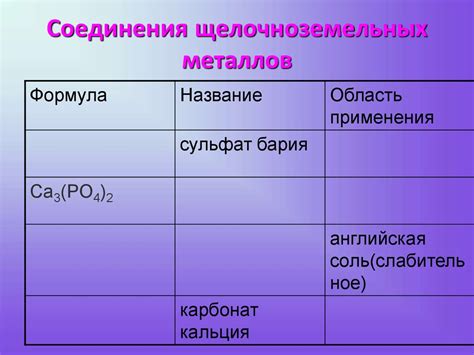
В химии существует множество различных соединений щелочных металлов, которые имеют свои уникальные названия. Они образуются при соединении щелочных металлов с другими элементами или группами, и каждое соединение имеет свою химическую формулу и особенности.
Соединения калия, например, включают такие названия, как калиев гидроксид (КОH), калий хлорид (КCl), калий бикарбонат (KHCO3) и др. Калиев гидроксид, также известный как пищевая щелочь, используется в пищевой промышленности для регулирования pH. Калий хлорид применяется в медицине, а калий бикарбонат широко используется в приготовлении пищи и в кулинарии.
Соединения натрия включают натрия хлорид (NaCl), натрия карбонат (Na2CO3), натрия гидроксид (NaOH) и другие. Натрий хлорид, или поваренная соль, является наиболее распространенным соединением натрия. Натрий карбонат используется в стекольной промышленности и для очистки воды. Натрия гидроксид, также известный как каустическая сода, находит применение в производстве мыла и моющих средств, а также в производстве бумаги.
Соединения лития включают лития гидроксид (LiOH), лития карбонат (Li2CO3) и др. Литий гидроксид используется в космической промышленности как средство регенерации воздуха на космических станциях. Литий карбонат находит применение в производстве стекла, лекарств и аккумуляторов.
И так далее, каждый щелочный металл имеет свои соединения с уникальными названиями, свойствами и применением. Знание этих соединений и их химических свойств является важным для понимания различных процессов и применений в химической промышленности и других отраслях.
Свойства соединений щелочных металлов
Соединения щелочных металлов имеют ряд характерных свойств, которые делают их особенно ценными в различных областях науки и технологии. Одной из основных характеристик этих соединений является их высокая реакционная активность. Они легко взаимодействуют с водой, кислородом, галогенами и многими другими веществами.
Соединения щелочных металлов обладают значительной электропроводностью. Это свойство делает их идеальными для использования в различных электронных устройствах, включая аккумуляторы и суперконденсаторы. Кроме того, эти соединения используются в процессах электролиза и для создания электролитов для элементов питания.
Щелочные металлы образуют стабильные соединения, что делает их надежными и долговечными материалами. Они обладают высокой плотностью и прочностью, что позволяет использовать их в производстве различных конструкционных материалов. Например, литий-ионные батареи, которые основаны на соединениях лития, являются одним из самых популярных и эффективных источников электроэнергии для портативных устройств.
Соединения щелочных металлов также обладают специфическими свойствами, которые делают их полезными в различных отраслях науки и промышленности. Например, углекислота, получаемая при взаимодействии щелочных металлов с углекислым газом, используется в качестве сырья для производства соды, стекла и других химических соединений. Кроме того, эти соединения используются в производстве огнетушителей, космических ракет и различных промышленных процессах, включая производство металлов и сплавов.
Применение соединений щелочных металлов

Соединения щелочных металлов имеют широкое применение в различных отраслях науки и техники. Они используются в процессе производства стекла. Натрий и калий, например, добавляются в стекло для придания ему прозрачности и устойчивости к воздействию окружающей среды.
Кроме того, соединения щелочных металлов часто применяются в производстве моющих средств и бытовой химии. Карбонаты натрия и калия являются основой для изготовления моющих порошков, жидких стиральных средств и губок для мытья посуды. Они обладают отличными моющими свойствами и способны эффективно удалять различные загрязнения.
В медицине соединения щелочных металлов также широко применяются. Например, ацетаты натрия и калия используются в качестве антикоагулянтов при проведении гемодиализа, а гидроксид калия применяется для регулирования уровня pH в крови.
Соединения щелочных металлов имеют также применение в производстве промышленных удобрений. Нитраты натрия и калия входят в состав многих удобрений, так как обеспечивают растения необходимыми для их роста и развития питательными веществами.
Кроме того, соединения щелочных металлов применяются в электрохимических процессах, таких как производство щелочных аккумуляторов и электролитов для электроприборов. Натрий и калий являются основными компонентами электролитов, которые обеспечивают прохождение электрического тока в электролитических реакциях.
Таким образом, соединения щелочных металлов широко используются в различных отраслях промышленности и науки благодаря своим уникальным свойствам и возможностям. Они нашли применение в производстве стекла, моющих средств, медицине, производстве удобрений и электрохимической промышленности, играя важную роль в современном мире.
Таблица свойств соединений щелочных металлов
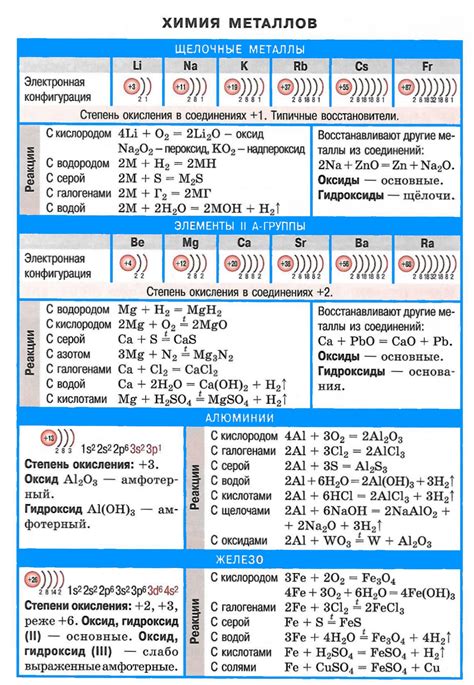
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом уникальных свойств и широким применением в различных областях науки и техники. Они являются самыми активными металлами, имеют низкую плотность и низкую температуру плавления. В соединении соединений щелочных металлов образуются ионы с положительным зарядом, что обуславливает их химическую активность.
Соединения щелочных металлов обладают рядом характерных свойств. Например, их соли часто образуют растворы, которые хорошо проводят электрический ток. Это обусловлено наличием свободных ионов, способных перемещаться в растворе. Кроме того, соединения щелочных металлов обладают высокой щелочностью и способностью нейтрализовать кислоты, образуя соли и воду.
Применение соединений щелочных металлов разнообразно. Калий и его соединения широко используются в сельском хозяйстве, в производстве удобрений и питательных растворов для растений. Некоторые соединения щелочных металлов применяются в производстве стекла, алюминия, катодов для аккумуляторов и других электротехнических устройств. Более тяжелые щелочные металлы, такие как рубидий и цезий, используются в научных исследованиях, в часах с атомным временем, а также в некоторых медицинских процедурах.
Соединения щелочных металлов имеют большое значение в мировой промышленности и науке. Их химические и физические свойства позволяют использовать их в широком спектре областей, от сельского хозяйства до электроники. Кроме того, исследования свойств и применение соединений щелочных металлов продолжается до сих пор, что позволяет нам лучше понять и использовать потенциал этих уникальных веществ.
Вопрос-ответ

Какова формула щелочных металлов?
Формула щелочных металлов обычно имеет вид MO, где M обозначает металл из данной группы, а O - атом кислорода.
Какие названия присущи щелочным металлам?
Названия щелочных металлов соответствуют их атомным номерам в периодической таблице: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие основные свойства имеют щелочные металлы?
Щелочные металлы обладают следующими свойствами: высокой реактивностью, низкой плотностью, низкой температурой плавления, способностью образовывать идеально кубическую кристаллическую решетку, хорошей электропроводностью и способностью образовывать ярко окрашенные соединения.
Для чего используются щелочные металлы?
Щелочные металлы находят широкое применение в различных сферах. Например, литий используется в производстве легких аккумуляторов и лекарственных препаратов, натрий применяется для производства соды и щелочи, калий используется в сельском хозяйстве в качестве удобрения, рубидий используется в научных исследованиях и производстве лазеров, цезий используется в атомных часах и ядерных реакторах, а франций имеет ограниченное применение из-за своей редкости и радиоактивности.
