Взаимодействие металлов, электролитов, полупроводников и газов является одной из основных тем в современной химии. Это изучение взаимодействия различных веществ позволяет понять и предсказать химические реакции и свойства веществ.
Металлы играют важную роль в химии, так как они обладают хорошей электрической и теплопроводностью. Они способны образовывать ионные соединения с электролитами. Электролиты представляют собой растворы ионов, которые могут проводить электрический ток. Взаимодействие металлов с электролитами приводит к электролитическим реакциям, в результате которых металлы могут вступать в окислительно-восстановительные реакции.
Полупроводники также имеют важное значение в современной технологии и электронике. Они обладают свойствами, промежуточными между металлами и изоляторами. При взаимодействии с различными веществами, полупроводники могут менять свою проводимость и электрохимические свойства, что делает их неотъемлемой частью таких устройств, как транзисторы и диоды.
Взаимодействие веществ в газообразной фазе также имеет место и важно для понимания химических реакций и процессов. Газы могут взаимодействовать между собой, образуя новые соединения или вызывая физические изменения в веществах. Это взаимодействие может быть с помощью химических реакций или физических процессов, таких как конденсация или испарение.
Изучение взаимодействия металлов, электролитов, полупроводников и газов позволяет расширить наши знания о химических свойствах веществ и применить их в различных отраслях науки и техники.
Фундаментальные взаимодействия между элементами
Фундаментальные взаимодействия между элементами являются основой для понимания различных процессов, происходящих с веществами в таблице средств. Одним из ключевых видов взаимодействий являются химические реакции, где элементы вступают во взаимодействие друг с другом и образуют новые соединения.
Другим важным типом взаимодействий являются электрохимические реакции, где происходит перемещение электронов между элементами. Это позволяет использовать различные металлы для создания гальванических элементов и батарей, где происходит преобразование химической энергии в электрическую.
Также, среди взаимодействий можно выделить физические процессы, такие как проводимость материалов или поглощение света. Эти процессы имеют особое значение в полупроводниковой промышленности, где различные материалы используются для создания электронных компонентов.
Взаимодействие металлов, электролитов, полупроводников и газов в таблице средств позволяет создавать различные устройства и материалы с необходимыми свойствами. Это открывает широкие возможности в различных областях, таких как электроника, энергетика, химическая промышленность и другие. Понимание и контроль этих взаимодействий является основой для развития новых технологий и улучшения существующих.
Металлы и электролиты: электрохимические процессы

Металлы и электролиты взаимодействуют между собой в электрохимических процессах, в которых происходят окислительно-восстановительные реакции. В этих процессах металлы могут выступать в роли окислителей или восстановителей, а электролиты - в роли проводников электрического тока.
Окислительно-восстановительные реакции происходят на границе раздела металла и электролита, где образуется электрод. Металл является анодом или катодом в зависимости от того, является ли он источником электронов или принимает их. Электролит, в свою очередь, содержит ионы, которые перемещаются к электродам и участвуют в реакции.
Процесс окисления металла в электролите называется реакцией коррозии. В результате коррозии металл медленно растворяется и образуются соединения, такие как оксиды, гидроксиды или соли. Это особенно заметно на металлической поверхности, которая теряет свою блескость и становится покрытой ржавчиной или другими продуктами коррозии.
Электрохимические процессы также могут использоваться для защиты металлов от коррозии. Например, метод гальванизации позволяет нанести на металлическую поверхность тонкий слой другого металла, который действует как анод в электролите и предотвращает коррозию основного металла.
Взаимодействие металлов и электролитов в электрохимических процессах является основой для работы различных электрохимических устройств, таких как аккумуляторы, гальванические элементы и электролитические клетки. Понимание этих процессов и их использование в технике позволяют нам создавать новые материалы, улучшать производительность и срок службы металлических изделий и разрабатывать новые энергетические и хранительные системы.
Полупроводники и металлы: ферми-уровни и диффузия
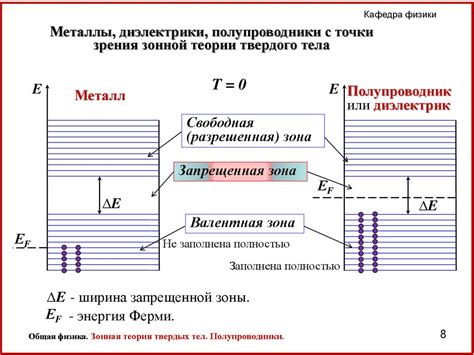
Полупроводники и металлы имеют существенные различия в своей структуре и свойствах, которые влияют на их взаимодействие с электролитами и газами. Одним из важных аспектов, связанных с этим взаимодействием, является различие в положении ферми-уровня у полупроводников и металлов.
Ферми-уровень представляет собой уровень энергии, при котором все состояния с нижней энергией заполнены электронами, а все состояния с более высокой энергией свободны. В полупроводниках ферми-уровень находится внутри запрещенной зоны энергий, что означает, что нет свободных состояний для движения электронов. В металлах же ферми-уровень лежит внутри зоны проводимости, поэтому электроны могут свободно двигаться.
Такое различие в положении ферми-уровня имеет важные последствия для диффузии в полупроводниках и металлах. Диффузия представляет собой процесс перемещения атомов или молекул вещества из области с более высокой концентрацией в область с более низкой концентрацией. В металлах диффузия происходит быстро благодаря наличию свободных электронов, которые способствуют перемещению атомов. В полупроводниках же, где свободные электроны отсутствуют или их количество значительно меньше, диффузия происходит значительно медленнее.
Таким образом, различное положение ферми-уровня в полупроводниках и металлах влияет на их взаимодействие с электролитами и газами, а также на процесс диффузии. Понимание этих особенностей позволяет более глубоко изучать и применять полупроводники и металлы в различных областях науки и техники.
Металлы и полупроводники: контактные явления
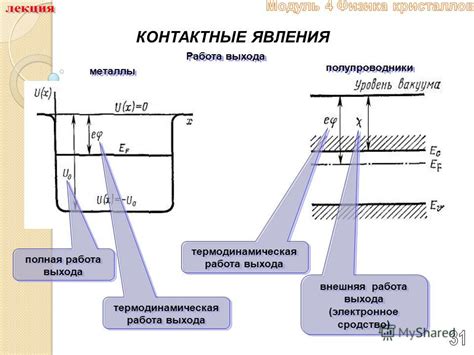
Металлы и полупроводники - это два основных типа веществ, которые могут взаимодействовать друг с другом при создании контакта. Контактные явления имеют большое значение в физике твердого тела и применяются в различных технологических процессах.
При контакте металла и полупроводника возникает контактная разность потенциалов, которая обусловлена различием в электронной структуре этих веществ. Контактная разность потенциалов может приводить к протеканию электрического тока, что делает эти материалы полезными для создания различных электронных устройств.
Контактные явления также могут приводить к образованию гетероструктур, то есть структур, состоящих из металла и полупроводника с различными электронными свойствами. Такие гетероструктуры широко используются в электронике и оптике для создания различных устройств, таких как светодиоды, фотодетекторы и лазеры.
Одной из важных характеристик контактных явлений между металлами и полупроводниками является сопротивление контакта. Сопротивление контакта зависит от многих факторов, таких как химический состав поверхностей веществ, степень очистки поверхностей и степень прижатия веществ друг к другу. Уменьшение сопротивления контакта является важной задачей при создании электронных устройств с высокой эффективностью и быстрой скоростью работы.
Таким образом, контактные явления между металлами и полупроводниками имеют большое значение в различных областях науки и техники. Понимание этих явлений позволяет разрабатывать новые материалы и устройства, а также улучшать существующие технологии в области электроники и оптики.
Электролиты и полупроводники: электролитическое травление
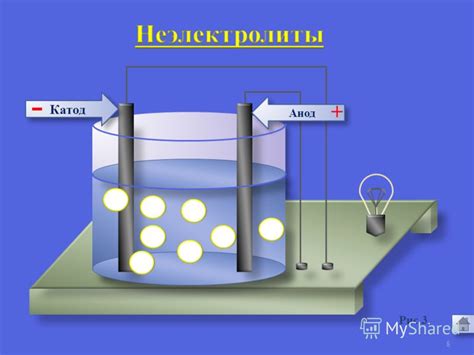
Электролитическое травление является процессом, который используется для создания микро- и наноструктур на поверхности полупроводников и металлов. Этот метод основан на использовании электролитической реакции, которая происходит в присутствии электролита.
Для проведения электролитического травления требуется специальная электролитическая ячейка, которая состоит из анода и катода, погруженных в электролит. Анодом обычно служит материал, который требуется травить, например, металл или полупроводник. Катодом может быть металл или другой материал, который не подвергается травлению.
Процесс электролитического травления основан на применении электрического тока к электролиту. При прохождении тока в электролите происходит электролиз веществ, что приводит к травлению поверхности анода. Электролитическое травление позволяет получить различные формы и глубины травления в зависимости от параметров электролита, тока и времени проведения процесса.
Электролитическое травление используется в различных областях, включая микроэлектронику, наноэлектронику и оптику. Оно позволяет создавать структуры с точностью до нанометров на поверхности полупроводников и металлов, что делает его важным инструментом для разработки новых технологий и устройств.
Металлы и газы: окисление и коррозия

Металлы и газы взаимодействуют друг с другом, что может привести к окислению металла и образованию коррозии. Окисление металла происходит при контакте с кислородом воздуха или другими окислительными газами. При этом металл постепенно теряет свою металлическую структуру и превращается в окислы.
Окисление металла может происходить как поверхностно, так и вглубь материала. Это зависит от свойств металла и условий окружающей среды. Например, железо при контакте с кислородом образует ржавчину - гематит или другие оксиды железа.
Коррозия металла, вызванная взаимодействием с газами, является одной из наиболее распространенных проблем в промышленности и бытовом использовании металлических изделий. Коррозия может привести к разрушению металлов и повреждению сооружений и оборудования.
Для защиты металлов от окисления и коррозии применяют различные методы. Один из них - использование защитных покрытий, таких как эмали или краски. Другой - применение специальных антикоррозионных покрытий, например, цинка или алюминия.
Также важным фактором в защите металлов от окисления и коррозии является контроль окружающей среды. Например, в автомобильной промышленности используются антикоррозийные добавки к горючим материалам, чтобы предотвратить образование ржавчины в топливной системе.
Электролиты и газы: гальваническая коррозия

Взаимодействие электролитов и газов с металлами может приводить к гальванической коррозии. Этот процесс является одним из наиболее распространенных способов разрушения металлических материалов и компонентов.
Гальваническая коррозия возникает при наличии двух разнородных металлов или металлических сплавов, которые находятся в электролитической среде. В результате этого взаимодействия происходит передача электронов между металлами, что вызывает коррозию более активного металла.
Один из основных факторов, определяющих скорость гальванической коррозии, является электрохимический потенциал каждого металла. Если металлы имеют большую разницу в потенциалах, то электронная передача будет происходить более активно, что приводит к усилению коррозии.
Помимо разницы в потенциалах, на скорость гальванической коррозии также влияют другие факторы, такие как концентрация электролитической среды, температура, наличие примесей и физико-химические свойства материалов.
Для предотвращения гальванической коррозии необходимо применять специальные методы и материалы, такие как защитные покрытия, изоляция, аноды и катоды. Также важно проводить регулярную проверку и обслуживание оборудования, чтобы оперативно выявлять и устранять возможные повреждения и потери из-за коррозии.
Полупроводники и газы: влияние окружающей среды
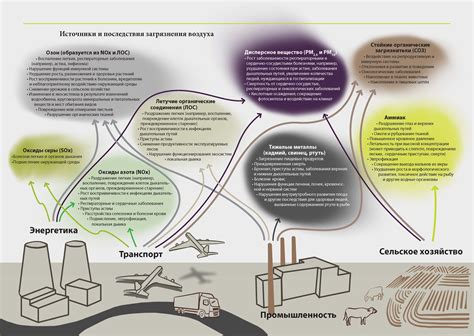
Полупроводники представляют собой материалы, которые в зависимости от условий могут проявлять различные свойства проводимости электричества. Одним из параметров, влияющих на свойства полупроводников, является окружающая среда.
Взаимодействие полупроводников с газами может привести к изменению их проводимости. Например, воздействие кислорода может вызывать окисление поверхности полупроводника и образование оксидных слоев, которые могут ухудшить его проводимость. В то же время, некоторые газы, такие как аммиак, могут создавать легированные слои на поверхности полупроводника, что может улучшить его проводимость.
Также важным фактором является влияние окружающей среды на температурные свойства полупроводников. При изменении температуры может происходить изменение энергетической структуры полупроводника, что в свою очередь влияет на его проводимость. Например, повышение температуры может привести к возникновению дополнительных неупорядоченных заряженных носителей, что повышает проводимость полупроводника.
Взаимодействие полупроводников с газами и окружающей средой имеет важное значение для различных технологических процессов. Например, контроль проводимости полупроводников путем изменения состава газовой среды позволяет создавать полупроводниковые приборы и электронные компоненты с определенными характеристиками. Также, понимание взаимодействия полупроводников с газами позволяет разрабатывать методы и технологии для защиты полупроводниковых устройств от нежелательного воздействия окружающей среды.
Металлы, электролиты, полупроводники и газы: взаимосвязь в различных условиях
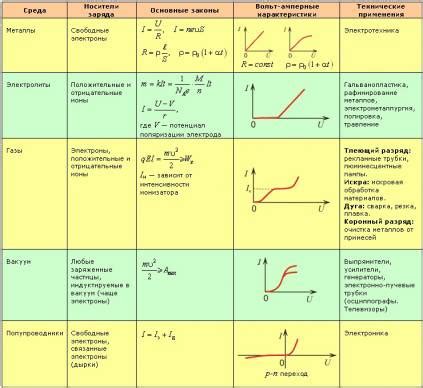
Металлы - хорошие проводники электричества и тепла, обладающие высокой пластичностью и эластичностью. Взаимодействие металлов с другими веществами зависит от их активности. Некоторые металлы реагируют с кислородом из воздуха, образуя оксиды, например, железо окисляется в воду и образует ржавчину. Металлы также могут взаимодействовать с кислотами, образуя соли и выделяя водород. Некоторые металлы могут взаимодействовать с щелочами, образуя соли и выделяя водород.
Электролиты - вещества, способные проводить электрический ток в растворе или в расплавленном состоянии. Раствор электролита может содержать положительно и отрицательно заряженные ионы. Процессы взаимодействия электролитов с металлами называют электрохимическими реакциями. Например, при погружении металла в раствор электролита может протекать процесс окисления или восстановления металла.
Полупроводники - вещества, обладающие средней проводимостью электричества. Они имеют два типа подвижных зарядов - электроны и дырки. Взаимодействие полупроводников с другими веществами может привести к изменению их проводимости и электрических свойств. Например, некоторые примеси могут увеличить проводимость полупроводников и использоваться для создания полупроводниковых приборов, таких как транзисторы и диоды.
Газы - вещества в газообразном состоянии, обладающие свойством заполнять всю доступную им объём герметичного сосуда. Взаимодействие газов с другими веществами может происходить при реакциях с кислородом или другими веществами, приводящими к образованию новых соединений. Например, газы могут взаимодействовать с металлами при горении или окислении, а также с электролитами в химических реакциях.
Вопрос-ответ

Какие металлы реагируют с водой?
В таблице средств есть несколько металлов, которые реагируют с водой, например, натрий, калий, кальций и магний. При взаимодействии этих металлов с водой образуется соответствующий гидроксид и выделяется водород. Реакция протекает достаточно активно и сопровождается выделением большого количества тепла.
Какие полупроводники широко используются в электронике?
В электронике широко используются полупроводники, такие как кремний, германий и галлий-арсенид. Эти материалы обладают свойством изменять свою проводимость под воздействием внешнего электрического поля или температуры. Полупроводники используются в производстве полупроводниковых приборов, таких как транзисторы, диоды и интегральные схемы.
Каково взаимодействие газов с металлами?
Взаимодействие газов с металлами зависит от конкретного газа и металла. Некоторые металлы могут реагировать с кислородом из воздуха, образуя оксиды, например, железо образует оксид железа. Некоторые металлы также могут реагировать с другими газами, например, алюминий реагирует с хлором, образуя хлорид алюминия. Взаимодействие газов с металлами часто сопровождается изменением свойств металла, например, образованием покрытия или изменением его структуры.
