Гальванический элемент ЭДС – это система двух электродов, состоящих из различных металлов и погруженных в электролит. При соединении такой системы с внешней цепью появляется электрический ток, а в результате химических реакций на электродах происходит расход или образование ионов.
В гальванической таблице металлов представлены различные металлы, отсортированные по их электрохимической активности. Этот порядок позволяет определить электродный потенциал каждого металла относительно водорода. Таким образом, можно составить таблицу металлов гальванического элемента ЭДС, где каждому металлу соответствует его потенциал.
Таблица металлов гальванического элемента ЭДС имеет широкое применение в электрохимии, электротехнике и производстве различных электрических устройств. Она помогает определить, какие металлы могут быть использованы в качестве анода или катода, а также предсказать направление электродных реакций и электродный потенциал системы. Это открывает возможности для создания различных гальванических элементов и аккумуляторов, а также позволяет уточнить выбор материала для различных электрохимических процессов.
Описание таблицы металлов гальванического элемента Эдс

Таблица металлов гальванического элемента Эдс является справочным инструментом, позволяющим оценить степень разность электродных потенциалов между различными металлами. Этот параметр называется электродной э. д. силой (Эдс) и определяет способность металла участвовать в гальванических реакциях.
Таблица представляет собой упорядоченный список металлов, начиная от самого активного до наименее активного. Каждому металлу в таблице соответствует его э. д. сила, выраженная в вольтах. Чем больше значение Эдс, тем активнее металл и наоборот.
Используя таблицу металлов гальванического элемента Эдс, можно определить, какие металлы могут использоваться в качестве анодов и катодов при создании гальванических элементов или аккумуляторов. А также, какие комбинации металлов приведут к максимальной генерации электроэнергии или, наоборот, будут электрически несовместимы.
Таблица металлов гальванического элемента Эдс является важным инструментом в области электрохимии и находит широкое применение в различных сферах, включая электроинженерию, электрохимические процессы и аналитическую химию.
Структура и принцип работы
Гальванический элемент Эдс представляет собой устройство, в котором происходят химические реакции, приводящие к преобразованию химической энергии в электрическую. Он состоит из двух электродов - анода и катода, которые находятся в электролите.
Анод представляет собой положительный электрод, на котором происходит окисление атомов металла. Катод - отрицательный электрод, на котором происходит восстановление атомов металла. Между анодом и катодом протекает электрический ток.
Принцип работы гальванического элемента Эдс основан на разности потенциалов между анодом и катодом. При окислении атомов металла на аноде происходит выделение электронов, которые двигаются к катоду. Катод принимает эти электроны и проводит реакцию восстановления атомов металла.
Электрический ток, проходящий через гальванический элемент, может быть использован для питания электрических устройств. Важную роль в работе гальванического элемента играет электролит, который является проводником для ионов и электронов, необходимых для прохождения реакций на аноде и катоде.
Структура гальванического элемента Эдс может быть представлена в виде таблицы, в которой указываются различные металлы и их стандартный электродный потенциал. По этой таблице можно определить, какие металлы будут работать в качестве анода и катода в данном элементе, и какая разность потенциалов будет между ними.
Основные металлы в таблице Эдс
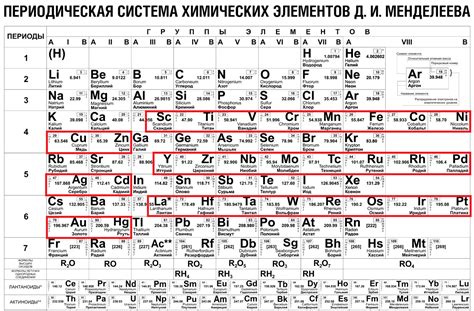
Таблица металлов гальванического элемента Эдс содержит перечень основных металлов, упорядоченный в порядке уменьшения их стандартных электродных потенциалов. Эдс (электродный потенциал) – это физическая величина, характеризующая способность вещества быть окисленным или восстановленным в реакции с другими веществами.
Наиболее активные металлы в таблице Эдс располагаются в верхней части списка, а наименее активные – в нижней. С помощью этой таблицы можно определить, какие вещества будут реагировать между собой, а также определить направление потока электронов в электрохимической реакции.
Среди основных металлов в таблице Эдс можно выделить такие вещества, как железо, цинк, медь, свинец, никель и другие. Железо является одним из самых распространенных металлов и имеет средний стандартный электродный потенциал. Цинк, в свою очередь, относится к более активным металлам и обладает отрицательным потенциалом.
Гальванический элемент, построенный на основе таблицы Эдс, позволяет получить электрическую энергию из химической реакции между различными металлами. Это применяется, например, в батарейках, гальванических аккумуляторах и других устройствах, где требуется источник постоянного электрического тока.
Применение и использование таблицы ЭДС в гальваническом элементе
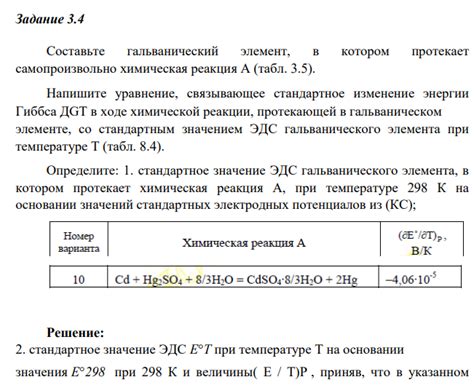
Таблица металлов гальванического элемента ЭДС широко применяется в различных областях, включая электрохимию, электротехнику и радиотехнику. Её основное назначение - расчет электродных потенциалов различных металлов и их использование в гальванических элементах для получения электрической энергии.
Таблица металлов гальванического элемента ЭДС позволяет определить относительный потенциал различных металлов в отношении выбранного эталонного электрода. Эти данные являются крайне важными при выборе материалов для создания гальванических элементов, таких как аккумуляторы, батареи и другие устройства, работающие на основе электрохимических реакций.
Использование таблицы металлов гальванического элемента ЭДС позволяет рассчитать разность потенциалов между двумя электродами для создания устойчивой электрической цепи. Это особенно важно при проектировании и создании электрических устройств, таких как источники питания, электрогальванические покрытия и другие приложения.
Таблица металлов гальванического элемента ЭДС также находит применение в химическом анализе, где используется для определения концентрации различных веществ. По измеренным электродным потенциалам металлов можно сделать выводы о скорости химических реакций и степени окисления или восстановления веществ.
В заключение, таблица металлов гальванического элемента ЭДС является неотъемлемым инструментом в электрохимии и электротехнике. Ее использование позволяет корректно проектировать и создавать гальванические элементы, а также проводить анализ электрохимических процессов с использованием электродных потенциалов различных металлов.
Преимущества и ограничения таблицы Эдс

Таблица металлов гальванического элемента Эдс является важным инструментом в области электрохимии и электротехники. Она позволяет определить электродный потенциал различных металлов и их способность к окислительно-восстановительным реакциям.
Одним из преимуществ таблицы Эдс является ее простота и удобство использования. Металлы расположены в таблице по убыванию их потенциала, что позволяет легко определить их относительную активность в гальванической ячейке. Кроме того, таблица также позволяет предсказывать направление течения электрического тока в различных сочетаниях металлов.
Однако таблица Эдс имеет и свои ограничения. Во-первых, она не учитывает другие факторы, такие как концентрация ионов, температура и другие условия реакции. Поэтому результаты, полученные с использованием таблицы Эдс, могут быть приближенными и требуют дополнительной проверки в практических условиях.
Во-вторых, таблица Эдс не учитывает взаимодействие металлов с различными электролитами. Гальванические элементы, построенные на основе таблицы Эдс, могут быть нестабильными или иметь низкую эффективность в различных электролитических средах. Поэтому при проектировании и расчете гальванических элементов необходимо учитывать конкретные условия эксплуатации.
Таблица металлов гальванического элемента Эдс является полезным инструментом для исследования электрических свойств металлов и их сочетаний. Однако при ее использовании необходимо помнить о ее ограничениях и проводить дополнительные эксперименты для более точных результатов и прогнозирования работы гальванических элементов в различных условиях.
Вопрос-ответ

Какие металлы входят в таблицу гальванического элемента Эдс?
В таблицу гальванического элемента Эдс входят такие металлы, как цинк, железо, медь, свинец, алюминий, никель, кадмий, серебро, олово, ниобий, платина и др.
Что такое гальванический элемент Эдс?
Гальванический элемент Эдс – это устройство, в котором происходят электрохимические реакции с участием различных металлов и ионов. Он основан на гальванической цепи, в которой происходит преобразование химической энергии в электрическую.
Какая закономерность наблюдается в таблице металлов гальванического элемента Эдс?
В таблице металлов гальванического элемента Эдс наблюдается закономерность: металлы расположены в порядке убывания электродного потенциала. То есть, чем больше электродный потенциал у металла, тем он более активен в реакциях окисления и восстановления.
Какие металлы считаются активными, а какие пассивными в гальваническом элементе Эдс?
Металлы считаются активными в гальваническом элементе Эдс, если их электродный потенциал более отрицателен, чем у их соседей. Например, цинк и железо являются активными. Пассивными металлами считаются те, у которых электродный потенциал более положителен. Например, медь и серебро.
