Металлы и кислородные соединения являются основными компонентами многих химических реакций, происходящих в природе и промышленности. Однако, чтобы понять и контролировать эти реакции, необходимо иметь полное представление о свойствах ионов металлов и остатков кислых соединений.
Таблица ионов металлов и остатков кислых соединений предоставляет информацию о заряде и свойствах этих ионов. Заряд ионов металлов зависит от их положения в периодической системе и способности отдавать или принимать электроны. Ионы металлов могут быть положительно заряженными (катионами) или отрицательно заряженными (анионами).
Остатки кислых соединений, с другой стороны, образуются при образовании ионов кислорода в соединении. Они обычно имеют отрицательный заряд и называются анионами. Остатки кислых соединений играют важную роль во многих биологических и промышленных процессах, так как они могут легко образовывать соединения с ионами металлов.
Наличие полной таблицы ионов металлов и остатков кислых соединений позволяет химикам и исследователям более эффективно понять и прогнозировать химические реакции и свойства различных соединений. Это также помогает в разработке новых материалов и технологий, основанных на химических ионных соединениях.
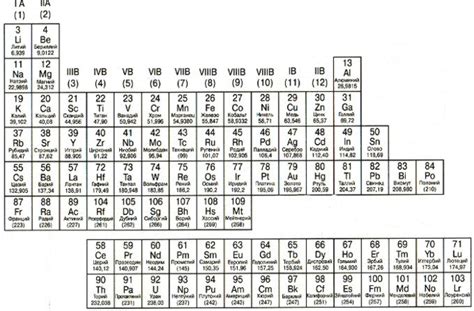
Таблица ионов металлов
Ионы металлов являются основными составляющими веществами, обладающими положительным зарядом. Они играют важную роль в химических реакциях и являются необходимыми для поддержания жизнедеятельности организмов.
В таблице ионов металлов перечислены основные металлы и ионы, которые они могут образовывать. Эти ионы могут иметь различные заряды, что определяет их роль и свойства в химических соединениях.
Некоторые металлы имеют только один стабильный ион. Например, натрий образует только катион Na+, а алюминий образует только катион Al3+. Другие металлы могут образовывать несколько ионов с различными зарядами. Например, железо может образовывать катионы Fe2+ и Fe3+.
Ионы металлов находят широкое применение в различных областях, таких как медицина, производство, электротехника и другие. Они представляют собой важные компоненты минералов, способствующих формированию костей и тканей, участвуют в электролитических процессах и осуществляют перенос электронов в реакциях окисления-восстановления.
Общие сведения:
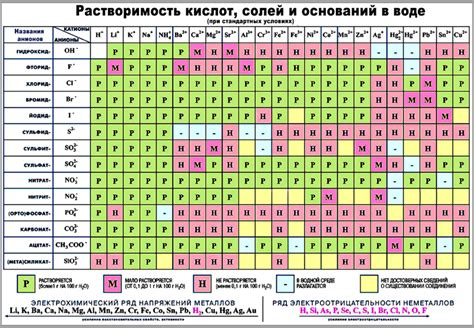
Таблица ионов металлов и остатков кислых соединений содержит информацию о различных ионах металлов, а также о соединениях, получаемых при реакции этих ионов с остатками кислых соединений. Данная таблица широко используется в химии для определения ионов и их соединений на основе реакций.
В таблице приведены различные металлы, их ионы и соединения, образуемые при реакции этих ионов с остатками кислых соединений. Ионы металлов могут иметь различные степени окисления, что влияет на их реакционную способность. Остатки кислых соединений представлены различными группами, такими как сульфаты, нитраты, хлориды и др.
Используя данную таблицу, можно предсказывать, какие ионы и соединения образуются при реакции конкретных металлов с остатками кислых соединений. Также можно сравнивать реакционную способность различных металлов и ионы, которые они образуют.
Металлы первой группы:
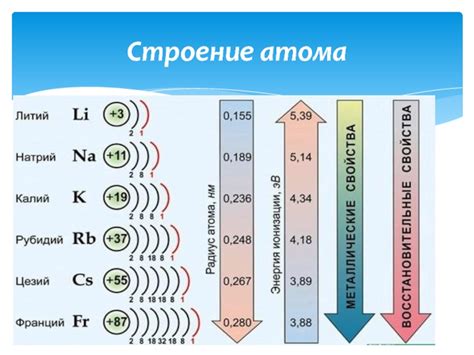
Металлы первой группы в периодической таблице химических элементов включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают общими свойствами ионизации электронов и образования положительных ионов.
Металлы первой группы обычно имеют низкую плотность и низкую температуру плавления. Они также являются высокоактивными и образуют прочные соединения с другими элементами, особенно с неметаллами.
Литий – наименьший по величине и наиболее легкий металл в первой группе. Он имеет низкую плотность и химически активен. Литий часто используется в производстве литиевых батарей и в различных лекарственных препаратах.
Натрий – очень распространенный элемент в земной коре и океанах. Он также является важным составным элементом пищи и основным ионом в организме человека. Натрий широко применяется в производстве стекла, щелочей и других химических соединений.
Калий – второй по значимости элемент в первой группе. Он играет важную роль в регулировании водного баланса в организме и является неотъемлемым элементом для растений. Калий используется в производстве удобрений и многих химических соединений.
Рубидий и цезий – это редкие элементы, которые встречаются в природе в очень малых количествах. Они применяются в научных исследованиях, в частности в атомных часах и фотоэлектрических устройствах.
Франций – это самый редкий и нестабильный элемент в первой группе. Все его изотопы являются радиоактивными и очень краткоживущими. Франций используется исключительно в научных исследованиях и имеет ограниченные коммерческие применения.
Металлы второй группы:
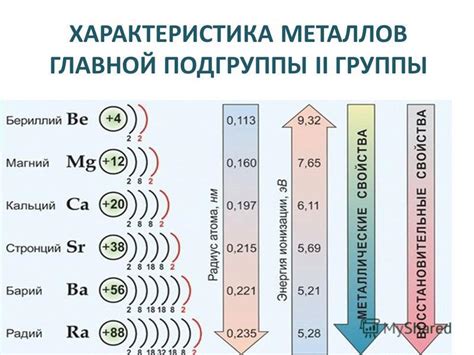
Металлы второй группы периодической таблицы характеризуются своими химическими свойствами, а именно способностью образовывать ионы со знаком +2. Это группа, включающая в себя 6 элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Бериллий – легкий, прочный металл, обладающий хорошей теплопроводностью. Он используется в производстве сплавов с другими металлами, такими как алюминий, медь и никель. Бериллий также находит применение в производстве ядерных реакторов и медицинской технике.
Магний – легкий металл, обладающий высокой силой и низкой плотностью. Он широко используется в авиационной и автомобильной промышленности, а также в производстве сплавов и огнестойких материалов. Магний является необходимым микроэлементом для человеческого организма и находит применение в медицине.
Кальций – важный макроэлемент для организмов живых существ. Он является строительным материалом для костей и зубов, а также участвует в регуляции сердечного ритма и нервной системы. Кальций используется в производстве строительных и отделочных материалов, а также в производстве стекла и цемента.
Стронций – металл, обладающий свойствами подобными кальцию. Он находит применение в производстве пиротехнических материалов и радиоактивных ионизирующих источников.
Барий – металл, используемый для производства салфеток для рентгенологии и в ядерной промышленности. Он также используется во взрывчатых веществах. Барий является ядовитым веществом и требует специальных мер предосторожности при его использовании.
Радий – очень редкий и радиоактивный металл. Он является естественным радиоактивным изотопом, который используется в исследованиях радиоактивности и в медицине для лечения рака. Радий является очень опасным веществом и требует строгого контроля при работе с ним.
Металлы третьей группы:

Металлы третьей группы периодической системы элементов включают в себя такие химические элементы, как скандий (Sc), иттрий (Y) и лантан (La). Они обладают рядом общих химических свойств и часто используются в различных отраслях промышленности и науки.
Особенностью металлов третьей группы является их способность формировать ионы с переменной степенью окисления. Например, скандий может образовывать ионы Sc2+, Sc3+ и Sc4+, в зависимости от условий реакции. Такое свойство делает эти металлы важными компонентами множества соединений и материалов.
Металлы третьей группы имеют широкое применение в различных отраслях промышленности. Например, лантан используется в катализаторах, электродных материалах и стекловарении, иттрий является важным компонентом твердых состояний лазеров и светодиодов, а скандий применяется в электронике и оптике.
Благодаря своим химическим и физическим свойствам, металлы третьей группы имеют большое значение для науки и техники. Их соединения и материалы находят применение в многих областях, от энергетики до медицины, и продолжают исследоваться для разработки новых технологий и материалов в будущем.
Металлы четвертой группы:

В таблице ионов металлов и остатков кислых соединений металлы четвертой группы включают такие элементы, как титан, цирконий и гафний. Эти металлы обладают сходными свойствами и могут образовывать положительные ионы с зарядом +4. Они являются известными материалами в инженерии и промышленности.
Титан (Ti) - легкий, прочный и коррозионно-стойкий металл, который широко используется в аэрокосмической промышленности и медицине. Титановые сплавы обладают высокими механическими свойствами, что делает их незаменимыми материалами для создания летательных аппаратов, имплантатов и других изделий, которые требуют прочности и низкого веса.
Цирконий (Zr) - серебристо-белый металл, который обладает высокой устойчивостью к коррозии и высокой температуре плавления. Цирконий используется в ядерной энергетике, химической промышленности, производстве сплавов и керамики. Циркониевые сплавы обладают высокой прочностью и стойкостью к агрессивным средам, поэтому они широко применяются в аппаратуре, работающей при экстремальных условиях.
Гафний (Hf) - серебристо-белый металл, похожий на цирконий по своим свойствам и химической активности. Он обладает высокой плотностью и крепостью, что делает гафний ценным материалом для аэрокосмической и ядерной промышленности. Гафниевые сплавы применяются в производстве двигателей, компонентов реакторов и других конструкционных элементов, которые должны выдерживать высокие температуры и загрузки.
Металлы пятой группы:
Металлы пятой группы - это группа металлов, которые относятся к пятому периоду таблицы и периодической системе элементов. В этой группе находятся такие элементы, как ванадий, ниобий и тантал. Каждый из этих элементов имеет свою уникальную химическую структуру и свойства.
Ванадий - это серебристо-серый металл, который обладает высокой термической и электрической проводимостью. Он также обладает высокой устойчивостью к различным химическим веществам и коррозии. Ванадий широко используется в производстве стали, сплавов и катализаторов.
Ниобий - это серый металл, который обладает высокой пластичностью и термической стабильностью. Ниобий используется в производстве сплавов, а также в электронике и суперпроводниковых материалах. Он также обнаруживает свойства устойчивого к нагреванию магнетика и часто используется в производстве магнитов.
Тантал - это серый металл с высокой плотностью и точкой плавления. Тантал является очень устойчивым к повреждениям и коррозии, и поэтому используется в производстве химических реакторов, электродов и элементов ядерных реакторов. Он также широко применяется в производстве электронных компонентов и суперпроводниковых материалов.
Остатки кислых соединений:
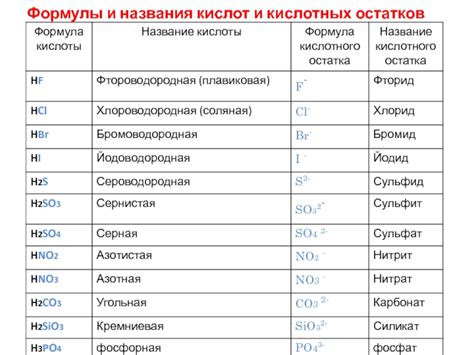
Остатки кислых соединений – это анионы, которые остаются после отщепления протона от кислоты в ходе ее диссоциации. Каждая кислота имеет свой остаток, который можно выделить и использовать для классификации кислотных соединений.
Остатки кислых соединений обладают отрицательным зарядом и выступают в реакциях кислых соединений в качестве анионов. Их заряд зависит от валентности элемента и количества присоединенных кислородных атомов.
Примеры остатков кислых соединений включают нитраты (NO3-), сульфаты (SO42-), карбонаты (CO32-), фосфаты (PO43-) и многое другое.
Остатки кислых соединений играют важную роль в различных областях науки и техники. Они являются важными компонентами удобрений, катализаторов и других химических соединений. Благодаря своей химической активности, остатки кислых соединений способны участвовать в различных реакциях и образовывать новые соединения.
Важно учитывать, что остатки кислых соединений могут взаимодействовать с различными металлами, образуя ионы металлов. Такие соединения могут активно участвовать в реакциях окисления-восстановления, катализировать различные процессы и применяться в различных отраслях промышленности.
Вопрос-ответ

Что такое ионы металлов и остатки кислых соединений?
Ионы металлов - это заряженные атомы металлов, которые образуются путем потери электронов. Остатки кислых соединений - это отрицательно заряженные фрагменты молекул кислых соединений после того, как они перестали быть кислотами путем отщепления одного или нескольких протонов.
Зачем нужна таблица ионов металлов и остатков кислых соединений?
Таблица ионов металлов и остатков кислых соединений является инструментом, который помогает идентифицировать и классифицировать различные соединения на основе их состава и заряда. Это позволяет ученым и химикам лучше понять химические реакции и связи между различными веществами, а также прогнозировать их свойства и поведение в различных условиях.
Как использовать таблицу ионов металлов и остатков кислых соединений при проведении химических экспериментов?
При проведении химических экспериментов таблица ионов металлов и остатков кислых соединений может быть полезна для определения ионных формул различных соединений, расчета ионных концентраций, прогнозирования направления химических реакций и предсказания образования осадков или выпадения газов при смешивании различных веществ. Она также может помочь в выборе оптимальных условий для проведения эксперимента и оценке его результатов.
