Электроотрицательность – фундаментальное понятие в химии, которое помогает определить разницу в электронной плотности атомов и, соответственно, химическую активность. В этой статье мы рассмотрим таблицу электроотрицательности металлов, которая является важным инструментом при изучении химических реакций и свойств веществ.
Таблица электроотрицательности металлов представляет собой перечень металлов, упорядоченных по их электроотрицательности. Каждому металлу присваивается определенное значение, которое отражает его способность привлекать электроны при образовании химических связей. Чем выше значение электроотрицательности, тем более активным металл считается.
Важно отметить, что таблица электроотрицательности металлов является относительной и базируется на электроотрицательности водорода, которой присваивается значение 2,1. Соответственно, металлы с более высокими значениями электроотрицательности считаются более активными по сравнению с водородом и другими металлами в таблице.
Металлы: что нужно знать о таблице электроотрицательности
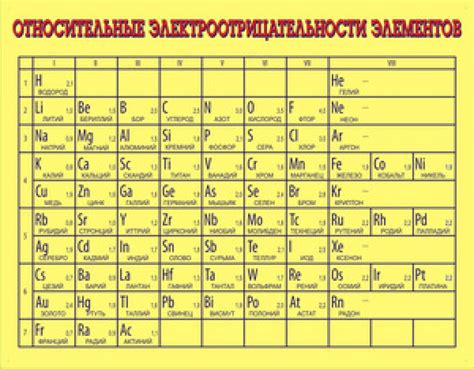
Таблица электроотрицательности металлов является важным инструментом для химиков и материаловедов. Электроотрицательность - это способность атома вещества притягивать электроны к себе в химической связи.
Металлы обладают низкой электроотрицательностью, что означает, что они имеют свойства "отдавать" свои электроны другим элементам в химических реакциях. Таблица электроотрицательности позволяет определить, какие элементы являются наиболее электроотрицательными, а какие - наименее.
Электроотрицательность металлов играет важную роль при определении их способности образовывать ионы или связываться с другими элементами. Например, металлы с низкой электроотрицательностью, такие как натрий или калий, легко реагируют с веществами с высокой электроотрицательностью, такими как кислород или хлор, образуя ионы. Такие реакции металлов с неметаллами являются основой многих химических процессов и имеют широкое применение в промышленности и технологии.
Таблица электроотрицательности металлов также позволяет определить полярность химических связей между различными веществами. Металлы с более низкой электроотрицательностью образуют полярные связи с веществами, имеющими более высокую электроотрицательность. Полярные связи характеризуются неравномерным распределением электронной плотности, что влияет на химические свойства вещества.
В итоге, знание таблицы электроотрицательности металлов позволяет более глубоко понять и предсказать свойства и взаимодействия металлических элементов в химии и материаловедении. Этот инструмент играет важную роль в разработке новых материалов, оптимизации процессов и создании новых технологий.
Понятие электроотрицательности металлов

Электроотрицательность металлов - это химическая величина, которая характеризует способность атомов металлов притягивать электроны во время химических реакций. Электроотрицательность является одной из важных характеристик металлов и определяет их химические свойства.
Электроотрицательность металлов обычно ниже, чем у неметаллов, что связано с особенностями их внешней электронной оболочки. Внешний электронный слой атомов металлов обычно имеет небольшое количество электронов, что делает их менее электроотрицательными.
Электроотрицательность металлов влияет на характер химических связей, которые могут образовывать с неметаллами. Металлы с низкой электроотрицательностью имеют большую склонность к образованию ионных связей, в то время как металлы с высокой электроотрицательностью могут образовывать как ионные, так и ковалентные связи.
Значение электроотрицательности металлов можно найти в специальной таблице электроотрицательности, которая помогает химикам определить характер химических реакций и предсказать образование молекул и соединений.
Роль электроотрицательности в химических свойствах металлов

Электроотрицательность является важным параметром, определяющим химические свойства металлов. Электроотрицательность характеризует способность атома притягивать электроны при образовании химических связей. Данный параметр влияет на ряд свойств металлов, включая их реакционную способность, способность к окислению и восстановлению, а также склонность образовывать ионы.
Высокая электроотрицательность металла свидетельствует о его способности активно взаимодействовать с другими элементами и соединениями, что обусловливает их высокую реакционную активность. Например, металлы с высокой электроотрицательностью, такие как кислород или фтор, обладают сильной аффинностью к электронам и проявляют свойства окислителей. В результате их взаимодействия с другими металлами происходит окисление последних.
Определенная величина электроотрицательности позволяет также оценить способность металла образовывать ионы. Металлы с низкой электроотрицательностью имеют тенденцию образовывать катионы, приобретая положительный заряд. Например, щелочные металлы, такие как литий или натрий, обладают низкой электроотрицательностью и образуют легко ионы Li+ и Na+, которые легко реагируют с отрицательно заряженными ионами или атомами других элементов.
Важность определения электроотрицательности для предсказания реакций металлов

Определение электроотрицательности является важным инструментом для предсказания реакций металлов и их способности образовывать химические связи с другими элементами. Электроотрицательность, которая характеризует способность атома притягивать электроны в химической связи, является ключевым показателем для оценки реакционной активности металлов.
Металлы обладают относительно низкой электроотрицательностью, что означает их склонность отдавать электроны в химической реакции. Это свойство делает металлы хорошими восстановителями и позволяет им образовывать ионы положительного заряда. Однако, степень реактивности металла может варьироваться в зависимости от его электроотрицательности.
Чем ниже электроотрицательность металла, тем выше вероятность его реакции с другими веществами. Электроотрицательность металлов можно сравнивать с помощью таблицы электроотрицательности, где каждому элементу присваивается численное значение. Чем выше значение, тем выше электроотрицательность.
Зная значения электроотрицательности различных металлов, можно предсказывать их способность взаимодействовать с другими веществами. Например, металл с высокой электроотрицательностью скорее всего будет образовывать ионы, а металл с низкой электроотрицательностью может быть более склонен к образованию соединений с другими элементами.
Таблицы электроотрицательности: принцип работы и применение
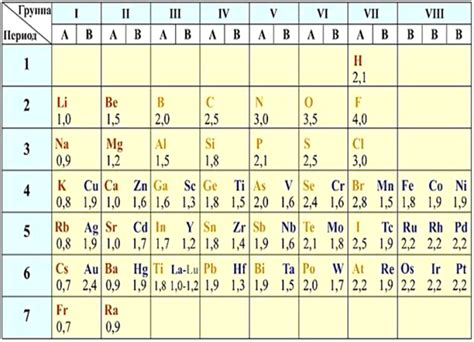
Таблица электроотрицательности – это классификация химических элементов по их способности привлекать электроны во время химической реакции.
Принцип работы таблицы электроотрицательности основан на том, что частицы с большей электроотрицательностью более сильно притягивают электроны, а частицы с меньшей электроотрицательностью менее сильно притягивают электроны.
Таблицы электроотрицательности имеют широкое применение в химии. Они позволяют предсказывать, какие химические элементы образуют стабильные катионы и анионы. Это полезно при проведении различных химических реакций и определении свойств соединений.
Также таблицы электроотрицательности используются для определения кислотности или щелочности соединений. Вещества с разными электроотрицательностями могут образовывать кислоты или основания, а их активность зависит от значения электроотрицательности.
Использование таблицы электроотрицательности позволяет легче понять и систематизировать данные о химических взаимодействиях, а также предсказывать и объяснять свойства различных элементов и их соединений.
Практическое значение электроотрицательности в ионно-молекулярной связи металлов
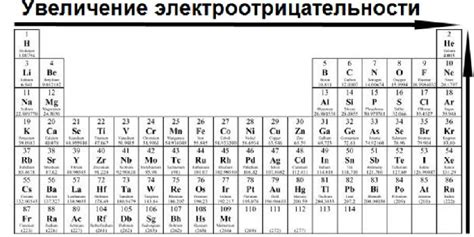
Электроотрицательность металлов играет важную роль в формировании ионно-молекулярной связи. Это свойство определяет, насколько сильно металл притягивает электроны в молекуле или ионе. Чем выше значение электроотрицательности, тем сильнее металл притягивает электроны и удерживает их у себя.
Высокая электроотрицательность металла может приводить к образованию положительно заряженных ионов, которые могут образовывать катионы при реакциях с неметаллическими элементами, имеющими высокую электроотрицательность. Это позволяет металлам образовывать ионные соединения с различными веществами, такими как соли, кислоты и основания.
Кроме того, электроотрицательность металлов имеет важное значение при определении их реакционной способности. Металлы с высокой электроотрицательностью могут быть более активными в химических реакциях, так как они с большей легкостью могут отдавать электроны. Низкая электроотрицательность, напротив, может указывать на низкую реакционную способность металла.
Следует отметить, что электроотрицательность металлов не является абсолютной величиной и может зависеть от условий их окружения. Тем не менее, она является важным показателем, используемым химиками для понимания и предсказания химической активности и свойств металлов.
Популярные методы измерения электроотрицательности металлов

Электроотрицательность металлов является важной характеристикой, которая определяет их химическую активность и способность образовывать химические связи. Существует несколько популярных методов измерения электроотрицательности металлов, которые позволяют установить их положение в таблице электроотрицательности.
- Метод Полинга. Данный метод основан на использовании электрохимической серии, которая включает в себя ряд металлов с известной электроотрицательностью. Путем сравнения потенциалов этих металлов с неизвестной электроотрицательностью можно определить последнюю.
- Кристаллографические данные. Измерение электроотрицательности металлов может быть осуществлено на основе анализа их кристаллической структуры. Данная методика основывается на измерении изменений в электронной плотности металла при совместном росте кристаллов различных металлических соединений.
- Метод Чарга-Колба. Этот метод основан на химической реакции металла с восстановителем или окислителем. Изменение заряда на поверхности металла позволяет определить его электроотрицательность.
Все эти методы имеют свои преимущества и ограничения, исходя из свойств металлов, которые требуется измерить. Использование нескольких методов может дать более точную оценку электроотрицательности металлов и помочь в составлении таблицы, которая будет полезной в химических исследованиях и промышленных процессах.
Вопрос-ответ

Что такое электроотрицательность металлов?
Электроотрицательность металлов - это их способность привлекать электроны в химической реакции. Чем выше значение электроотрицательности, тем сильнее металл притягивает электроны.
Зачем нужна таблица электроотрицательности металлов?
Таблица электроотрицательности металлов позволяет оценить и предсказать химические реакции между различными веществами. Она помогает определить, какие металлы более активны и способны образовывать соединения с другими элементами.
