Составление таблицы активности металлов - один из важных шагов в химических исследованиях. Эта таблица позволяет определить реакционную способность и активность металлов, что является ключевым фактором при выборе материалов для различных процессов.
Для составления таблицы активности металлов необходимо проводить ряд экспериментов. В основе этих экспериментов лежит сравнение способности металлов к протеканию реакций. Металлы, обладающие большей активностью, имеют более высокую способность реагировать с активными кислотами или вступать в реакцию с водой.
Один из методов составления таблицы активности металлов - это проведение реакции с известным окислителем. В этом случае металлы погружаются в растворы различных солей и наблюдаются реакции окисления-восстановления. По результатам эксперимента можно определить их активность и составить таблицу, где металлы располагаются в порядке увеличения их активности.
Как работать с таблицей активности металлов?
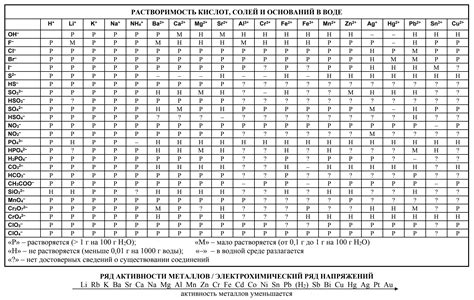
Таблица активности металлов позволяет оценить их способность реагировать с кислотами и водой. Для работы с таблицей активности металлов необходимо понимать, что активные металлы имеют большую способность к химическим реакциям, а неактивные – проявляют меньшую активность.
В таблице активности металлов металлы представлены в порядке убывания активности – от самых активных до наименее активных. Вертикальные группы представляют металлы, которые схожи по своим свойствам и химической активности.
Для определения активности металла можно использовать информацию из таблицы. При взаимодействии металла с кислотой, более активный металл вытеснит из раствора менее активный. Также можно определить активность металла, сравнивая его способность образовывать ионное соединение с кислородом. Чем выше в таблице металл, тем больше вероятность образования соединения с кислородом.
Таблица активности металлов является важным инструментом в химических исследованиях и позволяет понять, какие металлы могут образовывать стабильные соединения, а также предсказать, какие реакции могут происходить при контакте металла с водой, кислотами и другими веществами.
Составление таблицы активности металлов

Таблица активности металлов представляет собой перечень металлических элементов, упорядоченных по степени их активности. Эта таблица является полезным инструментом в химии, позволяющим определить возможность реакции металла с кислотой или другими веществами.
Для составления таблицы активности металлов необходимо провести серию экспериментов, включающих взаимодействие различных металлов с кислотами или растворами солей. В результате этих экспериментов можно определить, какие металлы являются более активными и способны реагировать с сильными кислотами, а какие металлы менее активны и реагируют только с более слабыми кислотами.
В таблице активности металлов металлы располагаются в порядке убывания их активности. Наиболее активные металлы находятся в верхней части таблицы, а менее активные – в нижней. Некоторые наиболее активные металлы, такие как калий и натрий, могут реагировать с водой с выделением водорода.
Составленная таблица активности металлов позволяет предсказать возможность и направление реакций между металлами и кислотами или другими веществами. Она является основным инструментом в изучении химических свойств металлов и степени их активности.
Определение активности металлов

Активность металлов определяется их способностью взаимодействовать с окружающей средой. Чем выше активность металла, тем больше он способен выявлять свои химические свойства при контакте с другими веществами.
Для определения активности металлов широко применяется таблица активности, в которой они располагаются в порядке убывания активности. Верхняя часть таблицы содержит наиболее активные металлы, а нижняя - наименее активные.
Используя таблицу активности металлов, можно предсказать результаты их химических реакций. Если металл находится выше другого в таблице, то он будет вытеснять его из раствора или соединения и образовывать новое вещество. Это явление называется окислительно-восстановительными реакциями.
Активность металлов также может быть определена с помощью потенциалов окисления-восстановления. Чем выше потенциал, тем активнее металл. При этом окислитель будет способен окислить вещество с более низким потенциалом.
Знание активности металлов позволяет не только объяснить различные химические реакции и их результаты, но и применять металлы в различных областях, таких как промышленность, медицина, строительство и другие.
Вопрос-ответ

Зачем нужна таблица активности металлов?
Таблица активности металлов используется для определения их реакционной способности. Она позволяет сортировать металлы по их способности вступать в реакцию с кислотами и другими веществами. Это необходимо для предсказания результатов химических реакций и выбора оптимальных условий для проведения процессов в химической лаборатории, промышленных производствах и т.д.
Какая информация содержится в таблице активности металлов?
В таблице активности металлов содержится информация о реакционной способности каждого металла. Каждому металлу присваивается свой реакционный потенциал, который показывает его склонность к окислительно-восстановительным реакциям. Ряды металлов в таблице располагаются в порядке возрастания активности, от самых пассивных до самых активных металлов.
Как определить активность металла по таблице?
Активность металла можно определить с помощью таблицы активности металлов, сравнивая его реакционный потенциал с потенциалами остальных металлов. Если металл находится выше другого по таблице, то он активнее и может вытеснить его из его соединений. Например, металл с более положительным реакционным потенциалом будет вытеснять водород из воды, а более отрицательный металл будет вытеснять металл с более положительным потенциалом из его соединения.
Какая информация получается при составлении таблицы активности металлов?
При составлении таблицы активности металлов получается информация о реакционной способности каждого металла. Она позволяет сравнивать активность металлов и определять их порядок в ряду активности. Также при составлении таблицы можно выявлять совместимость металлов при проведении электрохимических реакций и использовать эту информацию для создания гальванических элементов и аккумуляторов.
