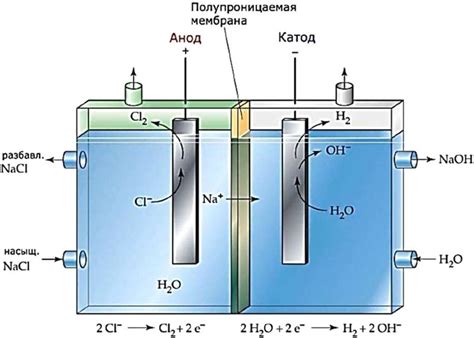
Электролиз является важным процессом в химии, который используется для разделения веществ на составные части с помощью электрического тока. Для эффективного проведения электролиза необходимо знать активность металлов, поскольку она определяет их способность к окислению или восстановлению. В таблице активности металлов перечислены различные металлы в порядке их активности.
Значения активности металлов представлены в таблице с помощью стандартного электрода водорода (SHE), который имеет нулевой потенциал. Металлы с положительными значениями активности могут быть окислены водородом, тогда как металлы с отрицательными значениями активности могут восстановиться водородом.
Например, в самом верху таблицы находится литий, у которого самое отрицательное значение активности (-3,04 В). Это означает, что литий может быть восстановлен водородом. С другой стороны, натрий, который имеет положительное значение активности (0,00 В), не может быть окислен водородом.
Значения активности металлов в таблице имеют важное практическое применение в различных областях, включая производство металлов, гальваническое покрытие, бытовую электрохимию и другие. Они помогают определить, какие металлы могут быть использованы в электролизе и какие процессы могут произойти при взаимодействии с другими веществами. Изучение таблицы активности металлов позволяет лучше понять и контролировать электрохимические процессы, что является важным для развития новых технологий и применений.
Определение активности металлов для электролиза
Активность металлов для электролиза – это способность металла принимать или отдавать электроны при проведении электрического тока через его раствор или плавящийся ионный кристалл. Активность металлов определяется их термодинамическим потенциалом окисления и редукции.
Для определения активности металлов используется таблица активности металлов. В этой таблице металлы располагаются в порядке убывания их активности. Металлы с большей активностью способны легче отдавать электроны, а металлы с меньшей активностью склонны принимать электроны.
Таблица активности металлов позволяет определить, какой металл будет участвовать в электролизе. Если металл находится выше в таблице по отношению к другому металлу, то он будет принимать электроны и происходить окисление (редукция) этого металла. В противном случае, если металл находится ниже в таблице, он будет отдавать электроны и происходить его окисление (редукция).
Таблица активности металлов имеет большое практическое применение. Она используется в различных областях, таких как гальваническое покрытие металлами, электролиз в промышленности, аккумуляторные батареи и многие другие. Знание активности металлов позволяет выбрать правильные условия проведения электролиза и достичь требуемых результатов.
Значение активности металлов для электролиза
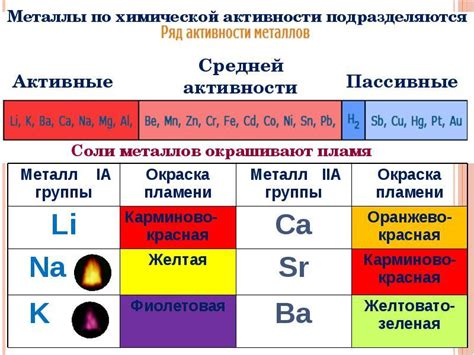
Активность металлов играет важную роль в процессе электролиза, определяя возможность и эффективность осаждения или растворения металлов. Активность металлов можно определить по их стандартному потенциалу, который показывает, насколько металл способен принимать или отдавать электроны в реакциях.
Для электролиза наиболее активные металлы, такие как натрий, калий и литий, разложатся из своих соединений в виде ионов уже при низких температурах и напряжениях. Такие металлы называются амфотерными, и они относятся к первой группе активности.
Для некоторых металлов, таких как железо, медь и свинец, электролиз может быть достигнут только при более высоких температурах и напряжениях. Для этих металлов процесс осаждения или растворения может осуществляться только при определенных условиях электролиза.
В таблице активности металлов для электролиза приведены значения стандартного потенциала для различных металлов. Металлы, имеющие положительные значения, имеют большую активность и склонность к растворению, в то время как металлы с отрицательными значениями имеют меньшую активность и склонность к осаждению. Эта информация позволяет выбирать металлы для различных процессов электролиза, основываясь на их активности и реакционной способности.
Значение активности металлов для электролиза имеет практическое применение в различных областях, например, в производстве металлов, получении металлических покрытий на поверхностях, электрохимических реакциях и многих других процессах, где требуется контролировать электролизные процессы для достижения нужного результата.
Применение активности металлов

Активность металлов для электролиза определяет их способность к химическому взаимодействию с веществами в растворе и использованию в различных процессах.
На основе активности металлов разрабатываются и применяются различные технологии. Например, электролиз используется для получения чистых металлов и соединений высокой чистоты. Активные металлы, такие как натрий и калий, используются в производстве алюминия и натриевых галогенидов.
Активность металлов также влияет на их способность вступать в химические реакции. Например, активные металлы, такие как калий и натрий, реагируют с водой, выделяя водород и образуя щелочные растворы. Это свойство активных металлов используется в химической промышленности для получения щелочей и других продуктов.
Таблица активности металлов является важным инструментом для выбора материалов и проектирования процессов. Она позволяет предсказать реакции между металлами и веществами в растворе, а также определить возможность электролиза и различные приложения.
Важно отметить, что активность металлов может меняться в зависимости от условий, таких как концентрация раствора и температура. Поэтому в реальных процессах необходимо учитывать не только значения активности металлов, но и окружающие условия для достижения желаемого результата.
Таблица активности металлов для электролиза
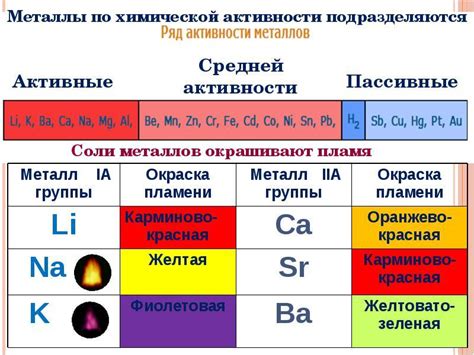
В химии и электрохимии существует таблица активности металлов, которая определяет их реактивность и способность быть окисленными или восстановленными. Эта таблица часто используется при проведении электролиза различных растворов и солей.
Металлы в таблице располагаются от самого активного до наименее активного. Наиболее активные металлы находятся в верхней части таблицы, а наименее активные - в нижней части. Активные металлы имеют большую склонность к окислению, а неактивные металлы - к восстановлению.
При электролизе, активные металлы, такие как натрий, калий или магний, образуют катионы и легко восстанавливаются на отрицательном электроде. Неактивные металлы, например, медь, никель или цинк, менее склонны к восстановлению и часто образуют анионы на положительном электроде.
Знание активности металлов для электролиза позволяет выбрать подходящие материалы для электродов и определить, какие реакции произойдут в процессе электролиза. Таблица активности металлов играет важную роль в практическом применении электролиза, позволяя обеспечить эффективность процесса и получить нужные продукты.
Значения активности металлов в таблице

Таблица активности металлов является основным инструментом для определения и сравнения их активности в химических реакциях, таких как электролиз. Значения активности металлов в таблице определяют их склонность к окислительно-восстановительным реакциям и позволяют сравнивать их способность к образованию ионов и соединений.
Значения активности металлов в таблице обозначаются числами, которые соответствуют их относительной активности. Наиболее активные металлы расположены вверху таблицы, а наименее активные - внизу. Например, литий, натрий и калий являются самыми активными металлами и имеют наибольшие значения активности. Медь, серебро и золото, напротив, являются наименее активными металлами и имеют самые низкие значения активности в таблице.
Значения активности металлов в таблице имеют практическое применение в различных областях. Одним из основных применений является электролиз, процесс разложения вещества под действием электрического тока. Значения активности металлов определяют, какие металлы могут быть использованы в качестве анодов и катодов в электролизе. Например, если металл имеет более высокую активность, чем другой металл, то он будет служить анодом, тогда как менее активный металл станет катодом.
Также значения активности металлов в таблице позволяют предсказывать реакции между металлами и растворами ионов металлов. Если металл имеет большую активность, чем ион металла в растворе, то произойдут окислительно-восстановительные реакции, при которых металл вытесняет ион из раствора и образует свое соединение. Например, цинк будет вытеснять ионы меди из раствора с солью меди, так как цинк имеет более высокую активность.
Сравнение активности металлов в таблице

Таблица активности металлов для электролиза представляет собой упорядоченный список металлов, отсортированных по их способности вступать в электролитические реакции. Чем выше металл находится в таблице, тем активнее он является.
Активность металлов в таблице имеет практическое значение при проведении электролиза. Металлы с высокой активностью, такие как калий, натрий и кальций, обладают большей способностью к реакциям и используются в процессах получения различных продуктов. Например, калий и натрий используются в производстве алюминия и соды, а кальций - в получении металлического кальция.
Сравнение активности металлов в таблице позволяет определить их способность выступать в реакциях электролиза и использовать их в промышленной и научной сферах. Металлы с низкой активностью, такие как серебро и золото, обычно используются в ювелирном и художественном производстве, где их стабильность и инертность важны для создания драгоценных украшений.
Сравнение активности металлов в таблице позволяет также определить способность металлов к окислению и восстановлению. Например, металлы с высокой активностью, такие как алюминий и магний, обладают большей способностью к окислению и восстановлению, что делает их полезными во многих промышленных процессах.
Преимущества и недостатки активности металлов для электролиза
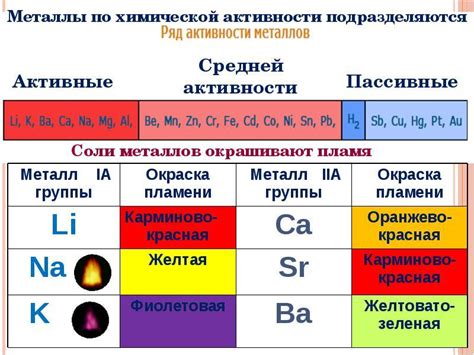
Активность металла является важным фактором при выборе материала для электролиза. Она определяет возможность процесса электролиза и его эффективность. Высокая активность металлов позволяет проводить электролиз с высоким КПД и получать продукты высокой чистоты.
Одним из основных преимуществ активных металлов таких, как калий, натрий и литий, является их высокая электропроводность. Это позволяет достичь высокой скорости реакции электролиза и сократить время процесса. Кроме того, активные металлы обладают низкими энергетическими потерями и могут быть использованы в экономически выгодных процессах.
Однако у активных металлов также есть некоторые недостатки. Они являются химически активными и реагируют с влажностью воздуха или водой. Это может привести к коррозии и образованию оксидов на поверхности металла, что снижает его электропроводность и эффективность.
Еще одним недостатком активных металлов является их высокая реакционность с другими веществами. Это может создавать сложности при проведении электролиза, особенно если в реакцию вовлечены несколько веществ. Также активные металлы могут быть опасными при неправильном обращении с ними из-за их высокой реакционности.
В целом, активность металлов является важным критерием при выборе материала для электролиза. Несмотря на некоторые недостатки, активные металлы обладают высокой электропроводностью и способностью к эффективному электролизу, что делает их полезными в различных промышленных и научных процессах.
Вопрос-ответ

Какую информацию можно узнать из таблицы активности металлов?
Из таблицы активности металлов можно узнать, какие металлы могут реагировать с водой или кислотой, а также какие металлы можно использовать для электролиза.
Какие металлы могут реагировать с водой?
Металлы, такие как натрий, калий, кальций и литий, могут реагировать с водой и образовывать гидроксиды и газ водород.
Что такое электролиз и как таблица активности металлов связана с этим процессом?
Электролиз - это процесс разложения вещества под действием электрического тока. Таблица активности металлов показывает, какие металлы могут быть использованы для электролиза, так как они способны быть окисленными или восстановленными.
Какие металлы можно использовать для проведения электролиза?
Металлы, такие как железо, цинк, медь и алюминий, могут быть использованы для проведения электролиза в различных процессах, таких как покрытие металлических изделий, получение металлов из руды и регенерация химических реагентов.
Какая роль таблицы активности металлов в промышленном производстве?
Таблица активности металлов является важным инструментом для промышленных производств, так как она позволяет определить наиболее подходящие металлы для проведения электролиза и обеспечивает эффективное использование ресурсов и процессов.
