Щелочные металлы - это элементы, которые находятся в первой группе периодической таблицы, включая литий, натрий, калий, рубидий, цезий и франций. Они обладают химическими свойствами, отличающимися от других элементов, захватывая воображение ученых и инженеров столетиями. Эти металлы взаимодействуют с водой и воздухом, образуя сильные основы, взрывоопасные соединения и светящиеся вещества. В отличие от большинства других металлов, щелочные металлы имеют низкую плотность и низкую температуру плавления, что делает их уникальными и важными во многих отраслях науки и техники.
Процесс превращения щелочных металлов начинается с их взаимодействия с водой или кислородом воздуха. Когда щелочный металл реагирует с водой, он образует щелочь и выделяет большое количество водорода. Эта реакция является экзотермической, вследствие чего возникает высокая температура и пламя, что делает этот процесс опасным и потенциально взрывоопасным.
Причины процесса превращения щелочных металлов до сих пор остаются объектом исследования и дебатов среди ученых. Однако, основной фактор, который влияет на этот процесс, - это высокая реактивность щелочных металлов. В связи с этим, их электрохимические свойства приводят к быстрой реакции с водой или кислородом, что приводит к образованию щелочи и обильному выделению горючих газов.
Этот процесс имеет не только научное значение, но и важное практическое применение. Знание о превращении щелочных металлов позволяет разрабатывать безопасные и эффективные методы утилизации этих материалов, а также использовать их в различных технологиях и научных исследованиях. Также, понимание причин и последствий этого процесса может помочь предотвратить непредвиденные аварии и бедствия, связанные с химическими реакциями щелочных металлов.
В заключении, процесс превращения щелочных металлов является важным исследовательским предметом, который имеет как научное, так и практическое значение. Эти металлы обладают уникальными свойствами и взаимодействуют с водой и воздухом, вызывая определенные превращения и последствия. Изучение этого процесса позволяет ученым лучше понять химическую природу щелочных металлов и использовать их в различных научных исследованиях и технологиях.
Роль щелочных металлов в химических реакциях

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в химических реакциях. Они характеризуются низкой ионизационной энергией и высокой реакционной способностью, что обеспечивает им активное участие во многих химических процессах.
Щелочные металлы обладают свойством образовывать стабильные ионы с положительным зарядом, что позволяет им образовывать ионообменные соединения с различными отрицательно заряженными атомами и группами. Это делает щелочные металлы важными веществами для использования в процессах ионообмена и образования солей.
Кроме того, щелочные металлы могут реагировать с кислородом, водой, некоторыми кислотами и галогенами. Например, они реагируют с водой, образуя гидроксиды и выделяя водород. Эти реакции широко используются в промышленности, особенно для производства гидроксидов щелочных металлов, которые используются в процессах очистки воды и производства моющих средств.
Щелочные металлы также могут вступать в реакцию с некоторыми неметаллическими элементами, такими как сера и фосфор, образуя соответствующие оксиды. Они также могут образовывать сплавы с другими металлами, что делает их полезными в металлургической промышленности.
Первичные свойства щелочных металлов

Щелочные металлы обладают рядом характеристик, которые делают их выдающимися элементами периодической системы химических элементов. Прежде всего, они являются чрезвычайно активными металлами, что объясняется их электрохимической природой.
Щелочные металлы имеют низкую плотность и низкую температуру плавления. При комнатной температуре они обычно являются мягкими и легкими металлами, которые могут быть легко разрезаны ножом или обработаны другими инструментами. Также они обладают низкой теплоемкостью и хорошей теплопроводностью.
Еще одной важной чертой щелочных металлов является их способность образовывать ионы, имеющие положительный заряд. Это связано с их низкой ионизационной энергией, которая делает их легко ионизуемыми.
Щелочные металлы обладают также низкими энергиями основных уровней электронной оболочки, что позволяет им легко отдавать свои электроны. Благодаря этому свойству они реагируют с водой, кислородом и другими веществами и могут вступать в реакцию с большим числом веществ.
Вольфрам — светло-серого цвета металл, твёрдый и хрупкий. Устойчив металл, который не окисляется на воздухе до 600°С. Вольфрам обладает наибольшей известной плавящейся температурой: 3410 °C.
Процесс ионизации щелочных металлов
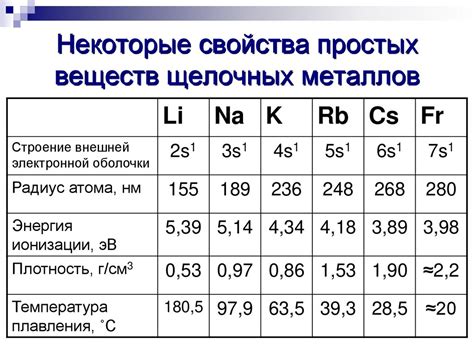
Ионизация щелочных металлов является важным физическим процессом, связанным с превращением атомов щелочных металлов в ионы. Щелочные металлы, такие как литий, натрий и калий, обладают одноэлектронной внешней оболочкой, что делает их очень реактивными. В процессе ионизации, один электрон может быть удален из атома, образуя положительно заряженный ион.
Ионизация щелочных металлов происходит в результате высокой энергии внешней оболочки и относительно слабой связи между внешним электроном и ядром атома. Вследствие этого, при взаимодействии с электромагнитным полем или химическими веществами, электрон может легко покинуть атом и стать свободным, образуя ион.
Ионизация щелочных металлов играет важную роль в химических реакциях и многих процессах, таких как электролиз и формирование солей. Ионы щелочных металлов имеют положительный заряд, что делает их электрофильными и способными к образованию ионных связей с отрицательно заряженными частицами. Это позволяет использовать щелочные металлы в широком спектре промышленных и лабораторных процессов.
Ионизация щелочных металлов имеет и свои последствия. Образование ионов приводит к изменению химических и физических свойств металлов. Например, ионы щелочных металлов становятся более активными в химических реакциях, что может привести к более интенсивной коррозии и образованию остаточных отложений на поверхностях, соприкасающихся с такими металлами.
Ионизация щелочных металлов имеет широкое практическое применение, например, в процессе электролиза для разделения различных элементов и производства стали. Кроме того, ионы щелочных металлов используются вакуумных трубках и сэндвичных панелях для контроля электронного потока и создания электрических полей.
Реакция щелочных металлов с водой

Реакция щелочных металлов с водой является одной из наиболее известных и изученных химических реакций. Щелочные металлы, такие как литий, натрий и калий, реагируют с водой взрывоопасно и протекает сильное окислительное взаимодействие. Каждый металл имеет свои особенности и последствия этой реакции.
Реакция щелочных металлов с водой приводит к образованию гидроксида металла и выделению водорода. При этом щелочные металлы обладают высокой химической активностью, что объясняет их способность реагировать с водой.
При контакте лития с водой продуктом реакции является легко растворимый гидроксид лития. Реакция протекает очень быстро и сопровождается выделением большого количества водорода. Из-за высокой активности лития такую реакцию не рекомендуется проводить без необходимых предосторожностей.
Натрий, как и литий, также реагирует с водой с образованием гидроксида натрия и выделением водорода. Однако, реакция натрия с водой проходит менее интенсивно, чем реакция лития. Вещества образовавшейся гидроксиды щелочных металлов обладают щелочными свойствами, что объясняет их название.
Реакция калия с водой происходит еще менее интенсивно, нежели реакция лития и натрия. Образующийся гидроксид калия обладает высокой щелочностью, что делает его опасным веществом. Калий может вызывать ожоги на коже и разрушение тканей, поэтому взаимодействие калия с водой требует особой осторожности.
Реакция щелочных металлов с водой приводит не только к образованию гидроксидов и выделению водорода, но и к значительному повышению температуры реакционной смеси. Это может приводить к возгоранию, поэтому проведение таких экспериментов требует строгого соблюдения безопасности и осторожности.
Образование гидроксидов щелочных металлов

Гидроксиды щелочных металлов образуются в результате реакции этих металлов с водой. Реакция протекает экзотермически и сопровождается выделением большого количества тепла и образованием щелочного раствора.
Наиболее известными гидроксидами щелочных металлов являются гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид лития (LiOH). Они обладают высокой щелочностью и широко используются в различных отраслях промышленности.
Образование гидроксидов происходит в результате реакции между щелочным металлом и молекулами воды. В результате реакции образуется ион гидроксида (OH-), который обеспечивает щелочность раствора. Гидроксиды щелочных металлов обладают высокой растворимостью в воде, что обуславливает их широкое применение в химической и фармацевтической промышленности, а также в бытовых условиях.
Образование и использование гидроксидов щелочных металлов имеет свои причины и последствия. Например, высокая щелочность гидроксидов обуславливает их способность нейтрализовать кислоты. Это делает их полезными в процессах очистки и нейтрализации отходов, а также в промышленности для контроля кислотности растворов.
Также гидроксиды щелочных металлов активно используются в процессах синтеза органических и неорганических соединений и как катализаторы в химической промышленности. Они играют важную роль в процессах гидролиза, окисления и других реакциях.
Стабильность гидроксидов щелочных металлов

Гидроксиды щелочных металлов – это соединения, образующиеся при реакции щелочного металла с водой. Они являются основаниями, и их стабильность зависит от ряда факторов.
Первый фактор, влияющий на стабильность гидроксидов щелочных металлов, – это электроотрицательность металла. Чем ниже электроотрицательность металла, тем больше он склонен образовывать стабильные гидроксиды. Например, гидроксид натрия (NaOH) является стабильным соединением, в то время как гидроксид лития (LiOH) нестабилен и быстро разлагается.
Второй фактор – это размер ионов металла. Чем больше ион металла, тем меньше энергии необходимо для образования стабильного гидроксида. Например, гидроксид калия (KOH) более стабилен, чем гидроксид лития, потому что ион калия больше по размеру.
Третий фактор – это концентрация ионов гидроксила (OH-) в растворе. Чем выше концентрация гидроксильных ионов, тем стабильнее гидроксид. Например, насыщенный раствор гидроксида натрия содержит высокую концентрацию ионов гидроксила, что делает его более стабильным.
Таким образом, стабильность гидроксидов щелочных металлов зависит от электроотрицательности металла, размера ионов металла и концентрации ионов гидроксила в растворе. Понимание этих факторов помогает объяснить причины и последствия процесса превращения щелочных металлов.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий и калий, имеют широкое применение в промышленности благодаря своим уникальным химическим и физическим свойствам. Они являются важными компонентами в различных отраслях, таких как производство стекла, алюминия, синтез органических соединений, аккумуляторы, литиевые батареи и многие другие.
Одним из наиболее распространенных применений щелочных металлов является использование натрия и калия в производстве стекла. Натрий добавляется в стеклянную массу для увеличения прочности и термической стабильности, а калий используется для придания стеклу специальных свойств, таких как устойчивость к высоким температурам и химическая инертность.
В процессе производства алюминия щелочные металлы находят свое применение в виде растворов. Литий используется в электролите для электролитического разложения оксида алюминия. Натрий используется в качестве катализатора для разложения алюминия из его оксидов. Калий, в свою очередь, применяется для облегчения процесса очистки и отделения алюминиевых сплавов.
Щелочные металлы играют важную роль в синтезе органических соединений. Они являются основными компонентами при получении различных химических веществ, таких как пластмассы, взрывчатые вещества, лекарственные препараты и т.д. Калий используется для производства удобрений, а натрий - в процессе производства мыла и стиральных порошков.
Щелочные металлы широко используются в аккумуляторах и литиевых батареях. Они позволяют хранить и использовать энергию с высокой эффективностью. Литиевые батареи нашли свое применение в мобильных устройствах, электромобилях и других портативных электронных устройствах. Натрий и калий широко применяются в промышленных аккумуляторах для транспортировки энергии и энергетического сектора.
Вопрос-ответ

Что такое процесс превращения щелочных металлов?
Процесс превращения щелочных металлов - это процесс, при котором щелочные металлы, такие как литий, натрий, калий, претерпевают превращение под воздействием различных условий или соединений. В результате этого превращения металлы могут изменить свою структуру, свойства и химический состав.
Какие условия и соединения могут привести к превращению щелочных металлов?
Превращение щелочных металлов может быть вызвано различными условиями и соединениями. Например, повышенная температура, наличие кислорода или других химических веществ, взаимодействие с другими металлами и т. д. Кроме того, щелочные металлы могут претерпевать превращение под воздействием электрического тока или при взаимодействии с водой или кислотой.
