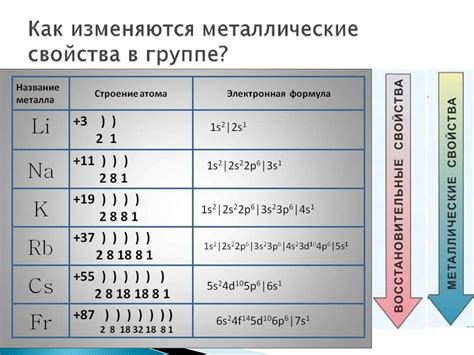
Атомы щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и другие, имеют своеобразное строение, которое отличается от строения атомов других элементов. Щелочные металлы относятся к первой группе периодической таблицы элементов и характеризуются наличием одного электрона в внешней оболочке. Это делает их особенно реактивными и способными образовывать ионы положительного заряда.
Строение атома щелочного металла можно представить с помощью электронной оболочки, которая состоит из электронных орбиталей. Первая электронная оболочка содержит только одну s-орбиталь, в которой находится один электрон. Остальные электроны находятся во второй электронной оболочке. Вторая электронная оболочка состоит из одной s-орбитали и трех p-орбиталей, каждая из которых может вместить по два электрона. Таким образом, общее число электронов в атоме щелочного металла равно двум.
Стоит отметить, что атомы щелочных металлов имеют большой размер и низкую электроотрицательность. Это связано с тем, что электроны на внешних орбиталях слабо придерживаются ядра атома и могут легко участвовать в химических реакциях. Благодаря этим особенностям, щелочные металлы обладают высокой химической реактивностью и широким спектром активности.
В заключение, строение атомов щелочных металлов определяется наличием одного электрона в внешней оболочке и соответствующей электронной конфигурации. Их большие размеры и низкая электроотрицательность делают их особенно реактивными и способными образовывать соединения с другими элементами. Изучение строения атомов щелочных металлов является важным шагом для понимания их химических свойств и возможных применений в различных областях науки и техники.
Строение атомов щелочных металлов
Атомы щелочных металлов обладают уникальным строением, которое отличается от атомов других химических элементов. Они представляют собой простые атомы, состоящие из ядра и электронной оболочки. Ядро атома содержит положительно заряженные протоны и нейтроны, а электронная оболочка состоит из отрицательно заряженных электронов.
Главной особенностью строения атомов щелочных металлов является наличие только одного электрона на внешней энергетической оболочке. Этот электрон является свободным и может легко взаимодействовать с другими атомами, образуя химические связи.
Кроме того, атомы щелочных металлов имеют больший размер по сравнению с другими элементами, что связано с наличием дополнительной энергетической оболочки. Этот факт определяет их химические свойства, такие как высокая активность и реакционная способность.
Стоит отметить, что атомы щелочных металлов обладают одноименным зарядом и поэтому склонны образовывать соли с отрицательно заряженными ионами других элементов. Это связано с тем, что электрон на внешней оболочке легко отделяется, что приводит к образованию ионов с положительным зарядом.
Таким образом, строение атомов щелочных металлов определяет их химические свойства и активность, делая их важными компонентами многих химических реакций и промышленных процессов.
Основные схемы атомов щелочных металлов

Атомы щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, имеют общую особенность - у них на внешнем энергетическом уровне всего один электрон. Это делает атомы щелочных металлов очень химически активными и склонными к образованию ионов.
Схема атома щелочного металла может быть представлена в виде электронной конфигурации, где каждому энергетическому уровню соответствует символ s или p и число, указывающее количество электронов на этом уровне. Например, электронная конфигурация атома лития может быть записана как 1s2 2s1, где цифра 1 обозначает энергетический уровень, символ s - тип орбитали, и цифры указывают количество электронов на данном уровне.
Еще одной схемой представления атомов щелочных металлов является электронная формула Льюиса. В такой схеме каждый электрон в атоме представлен как точка, размещенная на плоскости вокруг символа атома. Например, для лития электронная формула Льюиса будет выглядеть как Li •, где точка символизирует один внешний электрон.
Важно отметить, что атомы щелочных металлов стремятся достичь стабильной электронной конфигурации путем отдачи своего внешнего электрона. Это свойство позволяет им легко образовывать положительные ионы, которые имеют один электрон в меньшем количестве, чем исходный атом.
Особенности строения атомов щелочных металлов

1. Электронная конфигурация. Атомы щелочных металлов обладают особенной электронной конфигурацией. У них одна валентная электронная оболочка, содержащая один электрон на s-орбитали. Это делает атомы щелочных металлов очень реактивными и склонными к образованию ионов.
2. Размер атомов. Атомы щелочных металлов являются самыми большими среди всех элементов таблицы. Это объясняется тем, что при заполнении электронных оболочек залежей от n=1 до n=6, число электронов увеличивается, а эффективное экранирование ядра электронами на внутренних оболочках увеличивается. В результате, электроны на валентной оболочке становятся менее притягательными и атомы щелочных металлов раздуваются.
3. Ионизационная энергия. Ионизационная энергия, необходимая для удаления электрона из атома щелочного металла, является низкой. Это связано с тем, что у атомов этих металлов только один электрон на валентной оболочке, который слабо притягивается к положительному заряду ядра. В результате, удаление этого электрона требует минимального количества энергии.
4. Реактивность. Атомы щелочных металлов являются очень реактивными. Они склонны образовывать ионы положительного заряда, отдавая валентный электрон другим атомам или молекулам. Это связано с их низкой ионизационной энергией и стремлением достичь более стабильной электронной конфигурации.
5. Свойства соединений. Щелочные металлы формируют стабильные соединения с различными элементами. Отдавая свой валентный электрон, они образуют галогениды, оксиды и гидроксиды. Многие из этих соединений обладают выраженными основными свойствами и используются в различных областях науки и техники.
Влияние строения атомов на свойства щелочных металлов

Строение атомов щелочных металлов существенно влияет на их свойства и химическую реактивность. Щелочные металлы, такие как литий, натрий, калий и др., обладают одной валентной электронной оболочкой и относятся к первой группе периодической системы. Это делает их очень активными в химических реакциях и отличными
Вопрос-ответ

Какова основная структура атомов щелочных металлов?
Атомы щелочных металлов имеют простую электронную структуру, состоящую из одного валентного электрона в s-подуровне. Один валентный электрон делает щелочные металлы очень реакционноспособными и химически активными.
Какова особенность строения атомов щелочных металлов?
Основная особенность строения атомов щелочных металлов в том, что у них на наиболее высоком энергетическом уровне находится всего один электрон.
Почему атомы щелочных металлов столь активны в химических реакциях?
Атомы щелочных металлов имеют только один валентный электрон, который находится на очень удаленном от ядра энергетическом уровне. Такое строение делает эти металлы очень неустойчивыми и готовыми активно взаимодействовать с другими веществами в химических реакциях.
Какие схемы строения атомов щелочных металлов существуют?
Существуют две основные схемы строения атомов щелочных металлов: сферическая и плоско-столбчатая. В сферической схеме электроны заполняют энергетические уровни вокруг ядра, формируя сферическую оболочку. В плоско-столбчатой схеме электроны формируют более плоские оболочки с характерными выступами на каждом уровне.
Какой периодический закон можно применить к строению атомов щелочных металлов?
Для строения атомов щелочных металлов можно применить периодический закон, согласно которому количество энергетических уровней в атоме увеличивается с номером периода. Таким образом, атомы щелочных металлов имеют один энергетический уровень на своем субпериоде.
