Связь между атомами в металлах обеспечивается металлической связью, которая является одной из особенностей данного класса веществ. Металлическая связь является одной из наиболее прочных и термостойких. Она образуется благодаря перекрывающейся волновой функции электронов внешней оболочки металлических атомов.
Металлы литий, включая периодическую таблицу элементов, располагаются в группе 1A и 2A, что означает, что у них во внешней оболочке находятся либо 1, либо 2 электрона. Такая конфигурация электронов способствует образованию металлической связи.
Для лития, которое находится в первой группе, всего один электрон в внешней оболочке. Этот электрон очень легко отделяется от атомного ядра, что делает литий очень реакционным металлом. Это также означает, что у лития существуют хорошие электропроводные свойства, поскольку электроны свободно движутся внутри металлической решетки и создают металлическую связь.
В общем, образование металлической связи между металлами литий обусловлено их электронной конфигурацией и способностью свободного движения электронов внутри жидкого или твердого металлического состояния.
Способы формирования металлической связи для лития
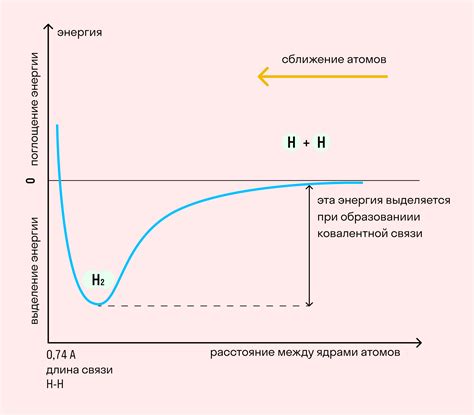
Литий — металл с атомным номером 3 в периодической системе элементов. Из-за своей низкой электроотрицательности и малого размера атома, литий обладает способностью образовывать металлическую связь.
Самым распространенным способом формирования металлической связи для лития является кристаллическая решетка. В кристаллической решетке каждый атом лития окружен соседними атомами, с которыми образует ковалентные связи. Такая решетка обеспечивает стабильность и прочность металла.
Другим способом формирования металлической связи для лития является образование электронных облаков. Атомы лития отдают свои валентные электроны в общую электронную оболочку, образуя так называемое "море электронов". Такая связь обеспечивает электропроводность и термическую проводимость металла.
Также можно отметить, что литий может образовывать сплавы с другими металлами. При образовании сплавов атомы лития смешиваются с атомами других металлов, что приводит к формированию металлической связи.
Ионные схемы образования металлической связи

Металлическая связь является одной из основных форм связи в металлах. Рассмотрим ионные схемы образования металлической связи для металлов литий.
Литий является металлом с наименьшей атомной массой среди всех металлов. В его атоме всего один электрон на внешнем энергетическом уровне. Когда атомы лития соединяются, они стараются достичь стабильной октетной конфигурации путем отдавания этого электрона.
В ионной схеме образования металлической связи электроны в металлах существуют в виде мобильного "моря" отрицательно заряженных электронов, окружающих положительно заряженные ионы. Таким образом, в металле литии образуется сеть ионов Li+ и свободных электронов Li-. Свободные электроны могут свободно двигаться по всему объему металла, обеспечивая его высокую электропроводность.
Между ионами Li+ и свободными электронами возникают силы притяжения, связанные с положительным и отрицательным зарядами. Эти силы являются основой металлической связи и обеспечивают металлам их уникальные физические и химические свойства, такие как высокая теплопроводность, электропроводность и пластичность.
Электронные схемы образования металлической связи
Металлическая связь является основной формой связи между атомами в металлах. Она образуется благодаря особенностям электронной структуры металлов.
В металлической связи атомы металла отдают свои внешние (валентные) электроны, образуя общий электронный газ, в котором электроны движутся свободно между положительно заряженными ионами металла.
Основные электронные схемы, описывающие образование металлической связи, включают схемы Факоны, молекулярные, ферми и ротационные.
Схема Факона показывает образование металлической связи через взаимодействие между ионными ядрами и свободными электронами. В схеме молекулярной связи формирование металлической связи происходит за счет образования молекул, состоящих из положительно заряженного ядра и окружающих его электронов.
Фермиевская схема объясняет образование металлической связи через создание электронного облака вокруг ядер, где электроны занимают энергетические уровни по принципу Паули. Ротационная схема описывает процесс образования металлической связи через перекрывание взаимодействующих орбиталей электронов при образовании общих электронных облаков в кристаллической решетке.
Электронные схемы образования металлической связи помогают понять основные механизмы связи между атомами в металлах и использовать их в различных областях науки и техники.
Вопрос-ответ

Как образуется металлическая связь у металла литий?
Металлическая связь у металла литий образуется за счет взаимодействия его атомов лития между собой. В металлической решетке лития, каждый атом лития отделяется от других атомов, и электроны заполняют общие металлические орбитали, образуя так называемое "море электронов". Это делает литий хорошим проводником электричества и тепла, и придает ему металлические свойства.
Какова роль электронов при образовании металлической связи у лития?
Электроны играют важную роль в образовании металлической связи у металла литий. В металлической решетке лития, каждый атом лития отделяется от других атомов, и электроны заполняют общие металлические орбитали. Это создает так называемое "море электронов", которое отвечает за металлические свойства лития, такие как хорошая электропроводность и теплопроводность.
