Химическая связь – это основной принцип взаимодействия атомов, молекул и ионов, который обусловливает их стабильное существование и образование химических соединений. В зависимости от природы и характера взаимодействующих частиц могут образовываться различные типы связей: ионные, ковалентные и металлические.
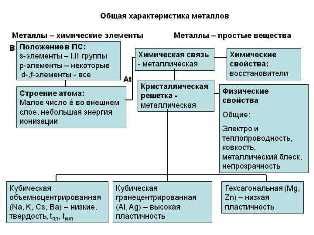
Металлы 2-й группы периодической системы – это химические элементы, которые обладают общими характеристиками, такими как электропроводность, металлический блеск и способность образовывать металлические связи. Металлическая связь – это особый тип химической связи, в которой два или более атомов металла образуют кристаллическую решетку и делят свои электроны, образуя облако свободных электронов.
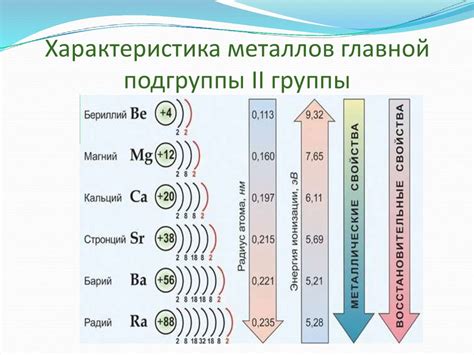
Схема химической связи для металлов 2-й группы включает в себя следующие ключевые характеристики: катионные радиусы, степень окисления, электроотрицательность и способность образовывать ионные соединения. Металлы 2-й группы, такие как магний, цинк и кальций, имеют два валентных состояния – +2 и +1, соответствующие их основному и окисленному состояниям.
Определение и значение металлов 2-й группы

Металлы 2-й группы - это химический класс элементов, который включает в себя бериллий, магний, кальций, стронций, барий и радий. Все эти элементы имеют общие характеристики и свойства, которые делают их важными для различных отраслей промышленности и научных исследований.
Одной из основных характеристик металлов второй группы является их способность образовывать стабильные и прочные ионные связи. Это делает их ценными для производства сплавов, электродов, кабелей и многих других материалов и изделий. Кроме того, металлы 2-й группы широко используются в производстве прочных конструкций, лёгких сплавов и высокотемпературных материалов.
Металлы второй группы также играют важную роль в медицине. Например, бериллий применяется в рентгеновской диагностике, а магний используется в процессе выделения ионов кальция в организме. Кальций, стронций и барий являются неотъемлемыми элементами костной ткани и играют ключевую роль в обеспечении прочности и здоровья костей и зубов.
Металлы 2-й группы также имеют значительное значение в энергетике. Благодаря своей высокой проводимости, металлы этой группы применяются в производстве проводов и кабелей для передачи электроэнергии. Кроме того, барий используется в производстве ядерных топливных элементов и в реакторных установках для получения энергии.
Таким образом, металлы 2-й группы являются важными и неотъемлемыми элементами в различных отраслях промышленности и науки. Их химические и физические свойства способствуют развитию технологий и повышению качества жизни человека.
Свойства и характеристики металлов 2-й группы

Металлы 2-й группы периодической системы характеризуются рядом свойств, обусловленных их атомным строением и структурой кристаллической решетки.
Одним из основных свойств металлов 2-й группы является высокая электропроводность. Это связано с наличием в их структуре свободных электронов, которые могут легко двигаться по кристаллической решетке, обеспечивая электрическую проводимость вещества.
Еще одним характерным свойством металлов второй группы является хорошая теплопроводность. Подобно электронам, свободные электроны могут также передавать тепловую энергию через кристаллическую решетку.
Металлы 2-й группы обладают высокой пластичностью и деформируемостью. Это связано с отсутствием ковалентной связи между атомами и наличием слабой связи между слоями кристаллической решетки, что позволяет атомам перемещаться относительно друг друга без разрушения материала. Это свойство делает металлы 2-й группы легкодеформируемыми и применимыми в различных сферах производства.
Также металлы 2-й группы обладают высокой химической активностью. Они активно взаимодействуют с кислородом, образуя оксидные пленки на поверхности металла, которые играют роль естественного защитного слоя от дальнейшей коррозии. Однако, при нагревании или в условиях высокой влажности, металлы могут подвергаться растворению в кислотах или образованию гидроксидов.
Следует отметить, что металлы 2-й группы также характеризуются специфическими физическими свойствами, такими как относительно низкая плотность, высокая плавкость и горючесть. Некоторые из них, например, магний, являются самовоспламеняющимися веществами, что делает их применимыми в производстве специфических материалов.
Реакции металлов 2-й группы с кислотами
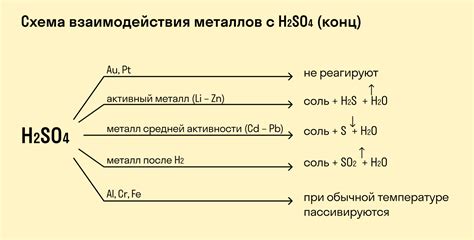
Металлы 2-й группы характеризуются высокой активностью и легкостью реагирования с различными веществами. Особенно ярко проявляется их реактивность при взаимодействии с кислотами.
Когда металлы 2-й группы вступают в реакцию с кислотами, образуется соль и выделяется водород. Реакция протекает с высвобождением энергии, сопровождается выделением пузырьков газа и образованием пены на поверхности реагирующих веществ.
В качестве кислот могут использоваться соляная кислота (HCl), серная кислота (H2SO4), азотная кислота (HNO3) и другие. Продукты реакции зависят от металла и конкретной кислоты, например, при реакции цинка (Zn) с серной кислотой образуется соль цинка (ZnSO4) и выделяется газовая сероводородная кислота (H2S).
Однако, не все металлы 2-й группы реагируют одинаково с кислотами. Например, магний (Mg) образует только водород, в то время как цинк (Zn) и кадмий (Cd) могут выбрасываться в виде осадка в результате реакции.
Составленная таблица (пример) позволяет лучше увидеть ограничения реакций металлов 2-й группы с различными кислотами:
| Металл | Соляная кислота | Серная кислота | Азотная кислота |
|---|---|---|---|
| Магний (Mg) | + | + | + |
| Цинк (Zn) | + | + | - |
| Кадмий (Cd) | + | + | - |
Таким образом, реакции металлов 2-й группы с кислотами являются химическими процессами, которые приводят к образованию солей и выделению водорода. Реакция зависит от идентичности металла и кислоты и может быть описана с помощью таблицы, которая отражает возможность реакции для каждой пары металл-кислота.
Образование и свойства оксидов металлов 2-й группы
Металлы 2-й группы периодической системы, такие как магний, цинк и кальций, образуют оксиды характерные для этой группы. Они имеют общую формулу MO, где M - металл. Образование оксидов металлов 2-й группы происходит при взаимодействии металлов с кислородом воздуха.
Оксиды металлов 2-й группы обладают рядом свойств. Прежде всего, они обладают высокой термической и электрической проводимостью. Это свойство обусловлено наличием свободных электронов в зоне проводимости. Оксиды металлов 2-й группы также обладают высокой твёрдостью и пластичностью.
Свойства оксидов металлов 2-й группы играют важную роль в их применении. Например, оксид магния (MgO) является одним из основных компонентов огнеупорных материалов. Оксид цинка (ZnO) широко используется в производстве резиновых изделий, косметических средств и солнцезащитных кремов благодаря своим защитным свойствам.
Свойства оксидов металлов 2-й группы также определяют их способность взаимодействия с другими веществами. Например, оксид магния образует растворимые соли при взаимодействии с кислотами. Оксид кальция (CaO) используется в процессе гашения извести, при котором происходит образование гидроксида кальция – основного компонента строительных материалов.
Схема и механизм химической связи для металлов 2-й группы
Металлы 2-й группы химической системы периодической таблицы обладают особыми свойствами и способностью образовывать химические связи с другими элементами. Для понимания механизма и схемы химической связи, необходимо рассмотреть их электронную структуру.
Металлы 2-й группы, такие как магний (Mg), цинк (Zn), кадмий (Cd) и ртуть (Hg), имеют общую электронную конфигурацию внешней оболочки s2. Это означает, что у этих элементов в оболочке находятся два электрона с противоположным спином и с высоким уровнем энергии.
Электроотрицательность металлов 2-й группы невысока, что создает благоприятные условия для образования химической связи с другими элементами. В основе химической связи металлов 2-й группы лежит ионная связь, которая возникает в результате передачи одного или нескольких электронов от металла к неметаллу.
В процессе образования химической связи с другими элементами, электроны внешней оболочки металла располагаются на доступных энергетических уровнях неметалла, что обеспечивает стабильность и прочность связи. Этот процесс знаменуется образованием ионов металла с положительным зарядом и анионов неметалла с отрицательным зарядом.
Резюмируя, схема и механизм химической связи для металлов 2-й группы основываются на электронной конфигурации металла, его электроотрицательности и процессе образования ионов. Понимание этих факторов позволяет объяснить свойства и поведение металлов 2-й группы в различных химических реакциях.
Комплексообразование металлов 2-й группы
Комплексообразование металлов 2-й группы является важным физическим и химическим процессом, который заключается в образовании стабильных комплексных соединений металлов с органическими или неорганическими лигандами. Эти соединения имеют сложную структуру и обладают различными свойствами, способными влиять на реакционную способность и физические свойства металлов.
Металлы 2-й группы, такие как магний (Mg), цинк (Zn), кадмий (Cd) и ртуть (Hg), образуют комплексы с различными лигандами благодаря своим электронным конфигурациям и особенностям их атомной структуры. Одним из самых известных комплексообразований металлов 2-й группы является образование глутатионата металлов, таких как глутатионат магния (Mg(GSH)2), глутатионат цинка (Zn(GSH)2) и глутатионат кадмия (Cd(GSH)2).
Глутатионатные комплексы являются важными для биологических процессов и участвуют в различных реакциях, таких как детоксикация тяжелых металлов, обмен веществ и защита клеток от окислительного стресса. Они образуются при взаимодействии металлов 2-й группы с глутатионом - мощным антиоксидантом, способным защищать клетку от разрушительного воздействия свободных радикалов.
Комплексообразование металлов 2-й группы играет важную роль не только в биологических системах, но и в промышленности. Например, комплексы цинка, кадмия и магния широко применяются в процессах катализа и синтеза органических соединений. Кроме того, комплексы этих металлов часто используются в качестве пигментов и красителей, а также в процессах гальваностегии и электролиза.
Роль и значимость металлов 2-й группы в промышленности
Металлы 2-й группы периодической системы являются важными материалами для промышленности. Они обладают рядом свойств, которые делают их незаменимыми во многих отраслях.
Во-первых, металлы 2-й группы имеют высокую пластичность и прочность, что позволяет их применять в производстве конструкционных элементов. Они используются для изготовления различных деталей и механизмов, таких как валы, шестерни, зубчатые колеса и другие элементы машин и устройств.
Во-вторых, эти металлы обладают хорошей электропроводностью, что делает их незаменимыми для производства электротехнических устройств. Они используются для изготовления проводников, контактов, разъемов и других деталей электрооборудования.
Кроме того, металлы 2-й группы также широко применяются в производстве сплавов. Сплавы этих металлов обладают уникальными свойствами, такими как высокая термическая и химическая устойчивость, что делает их незаменимыми в производстве инструментов, промышленной арматуры, авиационных и космических деталей.
Таким образом, металлы 2-й группы играют важную роль в промышленности благодаря своим уникальным свойствам. Их широкое применение позволяет улучшить качество и эффективность производства в различных отраслях экономики.
Применение металлов 2-й группы в повседневной жизни

Металлы 2-й группы периодической системы элементов полезны во многих аспектах повседневной жизни. Их уникальные свойства делают их незаменимыми в различных отраслях промышленности и быту.
Магний широко применяется в производстве автомобилей и авиационной промышленности. Этот легкий металл является основным компонентом сплавов, которые обеспечивают прочность и низкую плотность материалов. Магний также используется в производстве спортивных товаров, таких как гольф-клюшки и теннисные ракетки.
Цинк широко применяется в строительстве и машиностроении. Он используется для оцинковки металлических изделий, чтобы защитить их от коррозии. Цинковые покрытия также применяются в производстве батарей, аккумуляторов и солнечных батарей. Кроме того, цинк используется в производстве сплавов, в которых он придает материалам прочность и устойчивость к истиранию.
Кальций находит применение в многих сферах повседневной жизни. Он играет важную роль в строительной промышленности как основной компонент цемента. Кальций также необходим для здоровья человека, он является важным элементом в питательных добавках и лекарственных препаратах. Кроме того, кальций используется в производстве лаков, красок и пластиковых изделий.
Стронций применяется в светотехнике, в частности, в производстве красных светодиодов и светоотражающих покрытий для автомобилей. Этот металл также используется в радиоисотопной диагностике и в процессе синтеза фармацевтических препаратов. Стронциевые сплавы применяются в производстве специальных металлических конструкций.
Вопрос-ответ

Какие металлы входят во 2-ю группу периодической системы?
Во 2-ю группу периодической системы входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Что такое химическая связь в металлах 2-й группы?
Химическая связь в металлах 2-й группы представляет собой электростатическое взаимодействие между положительно заряженными ионами металлов и отрицательно заряженными электронами.
Какие особенности есть у схемы химической связи для металлов 2-й группы?
Основными особенностями схемы химической связи для металлов 2-й группы являются наличие двух внешних электронов на последней оболочке атома металла, образование двух электронных парных связей с другими элементами и возможность образования стабильного и надежного кристаллической решетки.
Какие соединения можно получить с использованием металлов 2-й группы?
Используя металлы 2-й группы можно получить различные соединения, такие как оксиды (например, оксид бериллия BeO, оксид магния MgO), гидроксиды (например, гидроксид бериллия Be(OH)2, гидроксид магния Mg(OH)2), соли (например, бериллийсульфат BeSO4, магнийсульфат MgSO4) и другие соединения.
