Металлы являются одной из основных групп химических элементов. Они обладают рядом характерных свойств, которые их отличают от других элементов. В целом, металлы можно назвать самыми распространенными элементами на Земле. Большинство всех известных элементов - металлы.
Основными химическими свойствами металлов являются:
1. Атомные и ионные свойства. Металлы образуют положительные ионы, отдавая электроны. Они обладают способностью образовывать ионы, что обусловлено наличием у них достаточного числа свободных электронов.
2. Реакция с водой и влажным воздухом. Большинство металлов вступает в реакцию с водой, образуя основания и выделяя водород. Однако, не все металлы реагируют с водой. Некоторые из них не растворимы в воде.
3. Реакция с кислотами и щелочами. Металлы активно реагируют с кислотами и щелочами, образуя соли. Они действуют как восстановители, отдавая электроны.
4. Способность быть окисляемыми. Металлы участвуют в различных окислительно-восстановительных реакциях, в процессе которых они могут окислиться, отдавая электроны.
Изучение химических свойств металлов в 9 классе является важным этапом обучения химии. Понимание этих свойств позволяет ученикам понять основы реакций и свойств металлов, а также их применение в различных отраслях промышленности.
Таким образом, знание химических свойств металлов имеет большое значение для учеников 9 класса, так как они могут быть использованы в будущем при изучении более сложных химических процессов и реакций.
Общие химические свойства металлов

Металлы, являясь одной из основных групп химических элементов, обладают рядом общих химических свойств. Эти свойства определяются особенностями строения атомов в металлах и их способностью образовывать ионные соединения.
Одной из главных характеристик металлов является их способность образовывать положительные ионы (катионы). Это связано с тем, что атомы металлов имеют мало электронов во внешней электронной оболочке и стремятся избавиться от лишних электронов, чтобы достичь стабильной конфигурации оболочек, подобной конфигурации газообразных инертных газов. Поэтому металлы активно взаимодействуют с другими элементами, передавая свои электроны и образуя ионные соединения.
Металлы также обладают хорошей теплопроводностью и электропроводностью. Это связано с наличием свободных электронов в кристаллической решетке металлов, которые перемещаются под действием внешнего электрического поля или теплового движения. Это делает металлы ценными материалами для проводников, таких как медь и алюминий, а также используется в промышленности для передачи тепла, например, в теплообменниках или радиаторах.
Также металлы обладают высокой пластичностью и прочностью. Это связано с их способностью к деформации без разрушения под воздействием механических сил. Металлы часто используются для изготовления различных конструкций, таких как машины, автомобили или здания, благодаря своей способности выдерживать большие нагрузки без поломок.
Схема классификации металлов
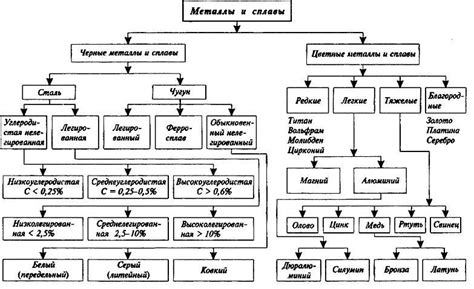
Металлы - это особый класс веществ, обладающих рядом характерных свойств. По своей структуре металлы представляют собой сеть атомов, образующих кристаллическую решетку. На основе их химических свойств металлы могут быть разделены на несколько категорий и подгрупп.
Одной из основных классификаций металлов является деление их на черные и цветные металлы. Черные металлы характеризуются темным цветом и высокой прочностью, такими, например, являются чугун и сталь. Цветные металлы, такие как медь, алюминий и цинк, имеют значительно более яркий цвет и хорошую проводимость электричества и тепла.
Другой важной классификацией металлов является деление их на активные и пассивные металлы. Активные металлы обладают способностью реагировать с кислородом, влагой и другими веществами, образуя оксиды и гидроксиды. К ним относятся, например, натрий, калий и магний. Пассивные металлы, такие как серебро и золото, обладают высокой устойчивостью к окружающей среде и практически не реагируют с другими веществами.
Также металлы можно классифицировать по одной из наиболее известных характеристик - их плотности. Некоторые металлы, такие как олово и свинец, обладают очень высокой плотностью, в то время как другие, например, литий и магний, имеют низкую плотность и легкую массу.
Классификация металлов по свойствам является необходимой для более глубокого понимания и изучения химических реакций и взаимодействия металлов с другими веществами. Эта схема помогает систематизировать и установить общие особенности металлов в зависимости от их химических свойств.
Особенности химических свойств щелочных металлов
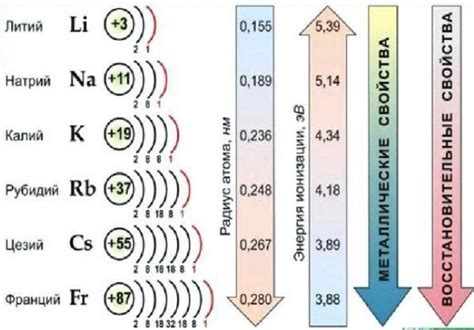
Щелочные металлы - это элементы первой группы периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом характерных химических свойств.
- Мягкость: Щелочные металлы являются мягкими и легко деформируемыми. Они могут быть резаны ножом или нарезаны ножницами.
- Низкая плотность: Щелочные металлы обладают низкой плотностью, что делает их легкими и летучими.
- Активность: Щелочные металлы являются очень активными химическими элементами. Они реагируют с водой, высвобождая взрывоопасный газ водород.
- Образование оксида: Они образуют оксиды, когда сгорают в воздухе. Оксиды щелочных металлов растворяются в воде, образуя щелочные растворы.
Особенности химических свойств щелочноземельных металлов

Щелочноземельные металлы - это элементы второй группы периодической системы. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы также обладают своими химическими особенностями.
- Наличие двух валентностей: Щелочноземельные металлы могут образовывать соединения, в которых у них валентность +2, а также такие, где валентность +1.
- Образование оксида: Как и щелочные металлы, щелочноземельные металлы образуют оксиды, когда сгорают в воздухе. Однако оксиды щелочноземельных металлов демонстрируют кислотные свойства и реагируют с щелочами.
- Реакция с водой: Реакция с водой у щелочноземельных металлов происходит менее интенсивно, чем у щелочных металлов, но тем не менее они также образуют гидроксид и выделяются водород.
- Катионы в соединениях: Щелочноземельные металлы часто образуют положительные катионы, которые обладают двумя электронами в валентной оболочке.
Особенности химических свойств переходных металлов

Переходные металлы - это элементы в 3-12 группах периодической системы, расположенные между щелочными и щелочноземельными металлами. Химические свойства переходных металлов также имеют свои особенности.
- Вариабельность валентностей: Переходные металлы могут образовывать соединения с различными валентностями. Это связано с возможностью изменять количество электронов во внешней оболочке.
- Образование разнообразных соединений: Переходные металлы могут образовывать разнообразные химические соединения, включая соли, оксиды и комплексные соединения.
- Каталитическая активность: Многие переходные металлы обладают каталитической активностью и могут участвовать в химических реакциях, ускоряя их без расходования самих металлов.
- Великое разнообразие цветов: Многие переходные металлы имеют разнообразные цвета, что связано с их способностью поглощать и испускать свет определенных длин волн.
Практическое применение металлов: свойства и области применения

Металлы являются одним из основных строительных материалов в различных отраслях промышленности и строительства. Благодаря своим уникальным свойствам, они обладают высокой прочностью, пластичностью и теплопроводностью, что делает их идеальными для использования в различных конструкциях.
Один из самых широко распространенных металлов - это железо. Оно используется для производства стали, которая является основным материалом для строительства зданий, мостов, автомобилей и других транспортных средств. Железо также применяется при изготовлении различных бытовых предметов, таких как посуда, посуда и посуда.
Алюминий - еще один важный металл, который широко применяется в строительстве и промышленности. Он обладает высокой коррозионной стойкостью и легкостью, что делает его идеальным материалом для создания облегченных конструкций, например, воздушных судов и автомобилей. Алюминий также используется в производстве различных упаковочных материалов, например, пластиковых бутылок и консервных банок.
Еще одним практическим применением металлов является их использование в производстве электроники. Медь, серебро и золото являются хорошими проводниками электричества, поэтому они широко применяются для создания проводов и контактов в электронных устройствах. Благодаря своей высокой электропроводности, эти металлы позволяют эффективно передавать электрический ток и обеспечивать надежное соединение.
Кроме того, металлы также находят широкое применение в медицинской и фармацевтической промышленности. Некоторые металлы, такие как титан и нержавеющая сталь, обладают высокой биосовместимостью и не вызывают аллергических реакций в организме. В связи с этим они успешно используются для создания имплантатов и медицинских инструментов.
В заключение, свойства металлов, такие как прочность, пластичность, теплопроводность и электропроводность, делают их незаменимыми во многих областях промышленности, строительства и технологии. Они находят применение в строительстве, производстве электроники и медицинских изделий, что делает их неотъемлемой частью нашей жизни.
Вопрос-ответ

Какие химические свойства характерны для металлов?
Металлы обладают рядом характерных химических свойств. Одно из главных свойств металлов - способность образовывать ионы положительных зарядов, так называемые катионы. Также у металлов имеется высокая электропроводность и теплопроводность. Они склонны к образованию ионных связей, а также способны реагировать с кислотами, образуя соли и выделяя водород. В результате взаимодействия металлов с веществами может происходить окисление или восстановление.
Чем отличаются окисление и восстановление металлов?
Окисление и восстановление металлов - две противоположные реакции, происходящие при взаимодействии металлов с веществами. Окисление - это процесс, при котором металл отдает электроны и образует положительный ион (катион). Восстановление - это процесс, при котором металл принимает электроны и образует отрицательный ион (анион). В результате окисления и восстановления металлов происходит изменение их степени окисления и образование соответствующих ионов.
