Кислоты и металлы являются важнейшими компонентами химической реакции. Взаимодействие между ними играет ключевую роль в процессах окисления и восстановления. Кислоты могут реагировать с металлами путем передачи протона, изменения степени окисления металла или образования солей.
Протонная передача является одним из основных механизмов реакции кислоты с металлами. В этом случае, кислота донор протона, отдает свой протон металлу-акцептору. Солюбильные кислоты, такие как соляная или серная кислоты, взаимодействуют с металлами, образуя соли и выделяя водород. Например, серная кислота реагирует с цинком:
H2SO4 + Zn → ZnSO4 + H2
Окислительно-восстановительные реакции также могут происходить при взаимодействии металлов с кислотами. В данном случае, металл увеличивает свою степень окисления, а кислота претерпевает восстановление. Например, соляная кислота окисляет медь, превращая ее в купрус(I) хлорид:
2HCl + Cu → CuCl2 + H2
Таким образом, схема взаимодействия кислот с металлами включает различные механизмы, такие как протонная передача и окислительно-восстановительные реакции. Эти процессы играют важную роль в химии и имеют широкое применение в различных областях, включая промышленность и науку.
Реакция кислот с металлами

Кислоты – это химические соединения, способные отдавать протоны в реакции с другими веществами. Кислотные реакции с металлами происходят в результате обмена протонов между кислотой и металлом.
Реакция кислоты с металлом основана на взаимодействии ионов металла с ионами водорода в кислоте. Чаще всего металл отдает один или несколько электронов, превращаясь в положительный ион, а ионы водорода принимают электроны, образуя молекулы водорода.
Некоторые металлы, такие как железо и цинк, реагируют с кислотами, при этом образуется соль и выделяется водород. Например, реакция железа с соляной кислотой приводит к образованию соли железа (III) хлорида и выделению молекулы водорода:
- Fe + 2HCl → FeCl2 + H2
Некоторые металлы, такие как алюминий и цинк, реагируют с сильными кислотами, такими как соляная кислота, серная кислота и азотная кислота, с выделением газа. Например, реакция цинка с соляной кислотой приводит к образованию соли цинка (II) хлорида и выделению молекулы водорода:
- Zn + 2HCl → ZnCl2 + H2
Однако некоторые металлы, такие как золото и платина, не реагируют с кислотами и остаются непроизводными. Это связано с их химической инертностью и низкой реакционной способностью.
Таким образом, реакция кислот с металлами представляет собой важный процесс в химии, который позволяет получать соли металлов и использовать их в различных областях науки и промышленности.
Процесс химического взаимодействия

Процесс химического взаимодействия между кислотами и металлами происходит на молекулярном уровне и включает в себя различные этапы.
Во-первых, молекулы кислоты и металла вступают в контакт друг с другом. Затем происходит образование новых связей между атомами этих веществ. Это может привести к образованию ионов, так как кислоты обычно обладают ионогенными свойствами. В результате этого этапа образуются новые вещества - соли.
Далее, происходит разрыв старых связей и образование новых связей в молекулах ионов. Этот этап сопровождается обменом электронами между ионами кислоты и металла. Кислота отдает одну или несколько своих электронов, а металл принимает эти электроны. В результате этой реакции происходит окисление металла и восстановление кислоты.
Окисление металла может происходить различными способами, в зависимости от химической природы самого металла и условий проведения реакции. Некоторые металлы могут окисляться лишь в присутствии кислорода, в то время как другие металлы могут окисляться и без его участия.
В результате процесса химического взаимодействия между кислотами и металлами происходит образование солей и выделение газов, таких как водород или диоксид углерода. Кроме того, возможно выделение тепла или изменение цвета реагирующих веществ.
Таким образом, процесс химического взаимодействия кислот с металлами является сложным и многоэтапным, включающим образование новых связей и обмен электронами. Эта реакция имеет широкое применение в химической промышленности и научных исследованиях.
Окислительно-восстановительные реакции
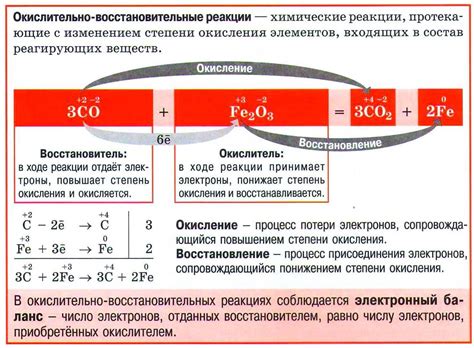
Окислительно-восстановительные реакции, или реакции окисления и восстановления, представляют собой важный тип химических реакций, при которых происходит перенос электронов между взаимодействующими веществами. В этих реакциях одно вещество теряет электроны и окисляется, а другое вещество получает электроны и восстанавливается.
Окислительно-восстановительные реакции широко распространены в химической промышленности и природных процессах. Они играют важную роль в электрохимических процессах, биологических реакциях и взаимодействии кислот с металлами.
Окислительно-восстановительные реакции можно представить в виде химических уравнений, в которых указываются изменение степени окисления атомов веществ и перенос электронов. Например, реакция между кислородом и водородом можно записать следующим образом: O₂ + 4H⁺ + 4e⁻ → 2H₂O.
В окислительно-восстановительных реакциях металлы часто выступают в роли восстановителей, т.е. они способны отдавать электроны другим веществам. Кислоты, в свою очередь, являются окислителями, т.е. веществами, способными принимать электроны от других веществ.
Влияние кислоты на металлы

Металлы подвергаются воздействию кислоты, что может привести к реакции между ними. Взаимодействие кислоты с металлами может происходить различными способами и зависит от свойств как самих кислот, так и металлов.
Кислоты способны взаимодействовать с металлами, образуя соли и выделяя водород. При этом некоторые металлы реагируют с кислотами очень активно, например, щелочные металлы, такие как натрий и калий. При контакте с кислотой они растворяются с выделением газа и образованием соответствующих солей.
Взаимодействие кислоты с металлами также может приводить к образованию сложных ионоорганических соединений. Например, серная кислота при взаимодействии с железом может образовывать железный сульфат. Это важно учитывать при работе с кислотами и металлами, так как реакция между ними может привести к изменению свойств исходных веществ, а также к образованию опасных продуктов.
Не все металлы подвержены воздействию кислот. Например, золото и платина практически не реагируют с кислотами и считаются химически инертными. Однако, даже для таких металлов могут существовать особые условия, при которых они могут взаимодействовать с другими веществами.
В целом, взаимодействие кислоты с металлами является важной химической реакцией, которая может приводить к различным последствиям. Поэтому необходимо учитывать свойства исходных веществ и проявлять осторожность при работе с кислотами и металлами.
Образование солей и ионных соединений
Соединения, образуемые при взаимодействии кислот и металлов, называются солями или ионными соединениями. Образование солей происходит в результате обмена ионами между кислотой и металлом.
При реакции кислоты с металлом происходит выделение водорода и образование ионной связи между катионами металла и анионами кислоты. Катионы металла и анионы кислоты притягиваются друг к другу и образуют кристаллическую решетку, в результате чего образуется соль.
Кристаллическая решетка соли состоит из положительно заряженных катионов металла и отрицательно заряженных анионов кислоты, которые равномерно распределены и упорядочены в пространстве. Эта решетка обладает определенной структурой и симметрией, что обеспечивает устойчивость соли.
Образование солей и ионных соединений имеет множество практических применений. Ионы в соли обладают электрической проводимостью и способны образовывать различные соединения, которые имеют широкий спектр применения в науке, промышленности и медицине.
Практическое применение реакций кислот с металлами

Реакции кислот с металлами имеют широкое практическое применение в различных областях.
В промышленности эти реакции используются для производства металлических солей. Например, реакция серной кислоты с железом дает сернокислый железный раствор, который может быть использован для окрашивания и консервации металлических поверхностей.
Кроме того, реакции кислот с металлами широко применяются в процессе гальванизации. В этом процессе на поверхность металла наносятся слои другого металла с помощью электролитической реакции. Так, реакция серной кислоты с цинком используется для нанесения защитного цинкового покрытия на стальные изделия.
Реакции кислот с металлами также применяются в лабораторной практике. Например, реакция хлороводородной кислоты с цинком используется для получения водорода. Этот газ далее может быть использован в различных химических процессах, а также в качестве топлива в водородных топливных элементах.
Помимо этого, реакции кислот с металлами находят применение в медицине и фармацевтике. Например, реакция соляной кислоты с железом используется для получения железа в виде пищевых добавок, которые используются для профилактики и лечения анемии.
В целом, реакции кислот с металлами являются важным инструментом химической промышленности и научных исследований. Применение этих реакций позволяет получить различные продукты, которые используются в различных отраслях человеческой деятельности.
Вопрос-ответ

Что такое схема взаимодействия кислот с металлами?
Схема взаимодействия кислот с металлами - это графическое представление процессов, которые происходят при контакте кислоты с металлической поверхностью. Она позволяет определить, какие продукты реакции образуются в результате этого взаимодействия.
Какие кислоты взаимодействуют с металлами?
Различные кислоты могут взаимодействовать с металлами. Например, серная кислота реагирует с металлами активной серии - железом, алюминием, цинком и др. Соляная кислота активно реагирует с металлами, такими как железо, медь, алюминий и другими. Азотная кислота может реагировать с металлами, такими как медь, свинец, никель и др.
Какие продукты реакции могут образоваться при взаимодействии кислот с металлами?
При взаимодействии кислот с металлами могут образовываться различные продукты реакции. Например, в результате реакции между соляной кислотой и железом образуется поваренная соль и водород. При взаимодействии серной кислоты с цинком образуется сульфат цинка и водород. В случае азотной кислоты и меди образуется нитрат меди и оксид азота.
Какие факторы могут влиять на скорость реакции кислоты с металлом?
На скорость реакции кислоты с металлом могут влиять различные факторы. Один из них - концентрация кислоты. Чем выше концентрация, тем быстрее протекает реакция. Также влияние оказывает температура - при повышении температуры происходит активация молекул кислоты и металла, что ускоряет реакцию. Кроме того, поверхность металла может также влиять на скорость реакции - чем больше площадь контакта между кислотой и металлом, тем быстрее протекает реакция.
