В мире химии семнадцать элементов называют металлами, и среди них особое место занимает самый активный металл – калий. Калий является легким, серебристо-белым металлом, обладающим рядом уникальных свойств и широким спектром применения. Однако, чтобы полностью понять его свойства, необходимо изучить его строение на атомном уровне.
Атом калия состоит из 19 протонов, 19 электронов и различного количества нейтронов, зависящего от изотопа калия. Основная часть массы атома калия сосредоточена в его ядре, в котором находятся протоны и нейтроны. Протоны обладают положительным зарядом, а нейтроны являются нейтральными по заряду частицами. Вокруг ядра атома располагаются электроны, которые обращаются по определенным орбитам, называемым энергетическими уровнями.
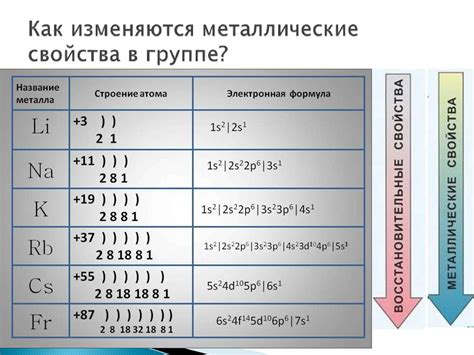
Количество электронов в атоме калия равно числу протонов – 19. При обращении по энергетическим уровням, электроны формируют электронные оболочки. Первая электронная оболочка включает 2 электрона, вторая – 8, а третья – 8. Оставшийся 1 электрон на четвертой оболочке делает калий химически активным, так как он стремится завершить свою внешнюю электронную оболочку.
Строение атомов калия определяет его химические свойства. Благодаря внешнему электрону, калий активно участвует в химических реакциях и обладает способностью легко отдавать один электрон другим атомам. Именно это делает его таким активным металлом и придает ему такие свойства, как высокая реакционность и хорошая проводимость электричества и тепла. Калий является необходимым элементом для организма человека и широко применяется в многих отраслях промышленности.
Свойства атомов металла
Атомы металла обладают рядом уникальных свойств, которые определяют их роль в химических реакциях и их использование в различных областях жизни.
Во-первых, атомы металла характеризуются высокой проводимостью электрического тока. Это связано с наличием свободно движущихся электронов, которые образуют электронное облако в металлической структуре. Именно благодаря этим электронам металлы могут быть использованы в электротехнике и производстве проводников.
Во-вторых, атомы металла обладают большой склонностью к окислению. Большинство металлов имеют низкую энергию ионизации, что делает их активными в химических реакциях. Это позволяет им образовывать ионы положительного заряда и участвовать в обменных реакциях.
Кроме того, атомы металла обладают химической реактивностью, то есть способностью взаимодействовать с другими веществами. Они могут образовывать соединения с неметаллами и другими металлами. Благодаря этой способности металлы активно применяются в химической промышленности и производстве различных материалов.
В целом, свойства атомов металла определяют их уникальность и широкое применение в различных сферах жизни. Это делает металлы незаменимыми для развития технологий и обеспечения прогресса человечества.
Строение и состав атомов
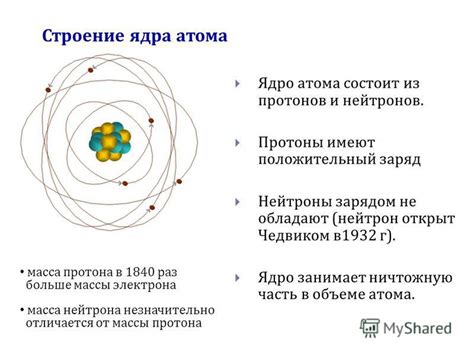
Атом – это наименьшая единица химического элемента, имеющая все его свойства. Он состоит из ядра и электронов, которые обращаются вокруг него. Строение атомов может быть представлено в виде модели Бора-Резерфорда, разработанной в начале XX века.
Ядро атома содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Вместе они образуют ядро, которое по сути представляет собой центральную часть атома. Около ядра вращаются электроны, которые имеют отрицательный заряд.
Число протонов в ядре определяет атомный номер элемента. Именно это число определяет его положение в Периодической системе химических элементов. Например, водород имеет атомный номер 1, кислород – 8, железо – 26.
Состав атомов также включает электроны. Они располагаются на электронных оболочках вокруг ядра. Количество электронов определяет электронную конфигурацию атома. Количество электронных оболочек равно номеру периода, на котором находится элемент в Периодической системе.
Строение и состав атомов являются основными характеристиками химических элементов и определяют их свойства и активность. Понимание структуры атомов позволяет лучше понять все процессы, происходящие на химическом уровне, и использовать это знание в практических целях, включая создание новых материалов и технологий.
Электронная структура атомов
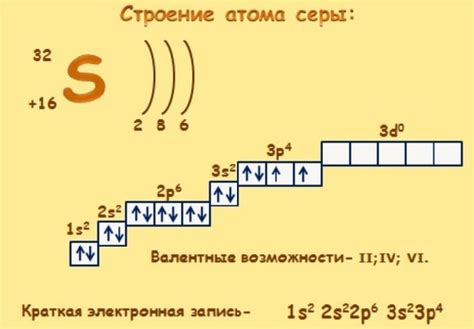
Электронная структура атома определяется расположением и движением его электронов. Электроны окружают ядро атома и находятся в различных энергетических уровнях, называемых электронными оболочками.
Каждая электронная оболочка может содержать определенное количество электронов. Первая оболочка может вместить не более 2 электронов, вторая оболочка - не более 8 электронов, третья - не более 18 электронов, и так далее.
Атомы металлов характеризуются своей электронной конфигурацией. Например, атом натрия имеет 11 электронов. Поэтому его электронная структура будет состоять из 2 электронов в первой оболочке, 8 электронов во второй оболочке и 1 электрона в третьей оболочке.
Атомы самого активного металла, франция, имеют свою специфическую электронную структуру. Франций имеет атомный номер 87, что значит, что у него 87 электронов. Это означает, что его электронная конфигурация будет иметь 2 электрона в первой оболочке, 8 электронов во второй оболочке, 18 электронов в третьей оболочке, 32 электрона в четвертой оболочке, 18 электронов в пятой оболочке и 9 электронов в шестой оболочке.
Электронная структура атомов металлов является основой для понимания их химических свойств. Она определяет их способность образовывать ионные связи, взаимодействовать с другими элементами и проявлять активность в химических реакциях.
Химические связи в металлических атомах
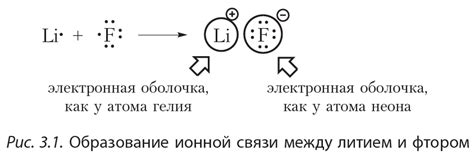
Металлические атомы обладают особым типом связи, называемым металлической связью. Она основана на способности металлов отдавать электроны и образовывать положительно заряженные ионы, которые образуют кристаллическую решетку. В металлической связи электроны свободно движутся по металлической решетке, создавая электронное облако, которое связывает атомы вместе.
Особенностью металлической связи является высокая электропроводность металлов. Электроны, свободно двигаясь по облаку, могут передаваться между атомами, обеспечивая перенос электрического заряда. Это объясняет хорошую проводимость металлов и их способность проводить тепло.
Металлическая связь также обуславливает специфические свойства металлов, такие как пластичность, деформация и способность образовывать сплавы. Благодаря гибкости электронной структуры, металлические атомы могут легко сдвигаться друг относительно друга, что позволяет металлам вытягиваться в проволоку или разбиваться на листы.
Кроме того, в металлических связях присутствует явление подвижности электронов. Это означает, что электроны имеют возможность перескакивать с одного атома на другой, образуя так называемую "электронную морею". Благодаря этой особенности, металлические материалы могут быть хорошими проводниками электричества и тепла, а также обладать уникальными магнитными свойствами.
Металлическая связь

Металлическая связь — это связь, образующаяся между атомами или ионами металла. При этом электроны свободно движутся внутри металлической решетки, что делает металлы хорошими проводниками электрического тока.
В основе металлической связи лежит модель "электронного газа", согласно которой валентные электроны металла находятся в постоянном движении и между собой взаимодействуют. Электроны образуют облако отрицательно заряженных зарядов, а положительно заряженные атомы или ионы металла находятся в среде электронного газа.
Ключевыми свойствами металлической связи являются высокая электропроводность и теплопроводность, а также хорошая пластичность и образование блестящих поверхностей. В металлической связи электроны свободно передвигаются от одного атома к другому, что позволяет металлам быть хорошими проводниками электричества и тепла.
Металлическая связь также обуславливает специфические свойства металлов, такие как деформируемость и пластичность. Благодаря подвижности электронов, металлы легко поддаются обработке и могут быть прокатаны, вытянуты или сплавлены для создания различных изделий.
Характеристики металлической связи
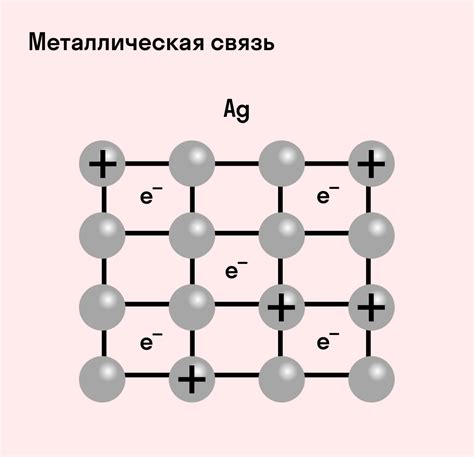
Металлическая связь - это особый тип химической связи, характерный для металлов. Она возникает из-за общих электронов в валентной зоне металлической решетки и является одной из основных причин уникальных свойств металлов.
Основные характеристики металлической связи:
- Проводимость электричества и тепла. Благодаря свободным электронам, металлы являются отличными проводниками электричества и тепла. Валентные электроны, свободные от конкретных атомов, могут свободно двигаться по всей металлической решетке, обеспечивая эффективную передачу заряда и тепла.
- Пластичность и деформируемость. Металлы обладают высокой пластичностью и деформируемостью, что позволяет им подвергаться различным видам обработки, включая ковку, прокатку и тянение. Это связано с возможностью свободного движения электронов и их способностью компенсировать внешнее воздействие.
- Металлический блеск. Металлы обладают характерным блеском, который связан с отражением света от свободно движущихся электронов. Блеск металлов делает их привлекательными для использования в ювелирных изделиях и декоративных элементах.
- Возможность образования сплавов. Металлы могут образовывать сплавы, смешиваясь с другими металлами или неметаллами. Это позволяет получать материалы с новыми свойствами, расширяя области их применения.
В целом, металлическая связь обуславливает уникальные свойства металлов и является основой для создания различных металлических материалов, которые широко используются в промышленности и повседневной жизни.
Вопрос-ответ

Какое строение имеют атомы самого активного металла?
Атомы самого активного металла имеют кубическую кристаллическую решетку.
Можно ли назвать самый активный металл атомарным?
Нет, самый активный металл не является атомарным, так как его атомы образуют кристаллическую решетку.
Что происходит с атомами самого активного металла при контакте с водой?
Атомы самого активного металла при контакте с водой реагируют, выделяя водород и образуя гидроксид металла.
Как связано строение атомов самого активного металла с его активностью?
Строение атомов самого активного металла, а именно их кристаллическая решетка, обеспечивает высокую реакционную способность металла, что делает его самым активным.
Что представляет собой кристаллическая решетка атомов самого активного металла?
Кристаллическая решетка атомов самого активного металла - это упорядоченное расположение атомов металла в пространстве, формирующее трехмерную структуру, например, кубическую решетку.
