Металлы и неметаллы – это основные классы элементов в периодической системе. У них сильно отличаются химические и физические свойства, что обусловлено различным строением и связью атомов. Разберем подробнее, какие именно различия существуют между строением атомов металлов и неметаллов.
Атомы металлов имеют довольно специфическую структуру. В основе строения лежит кристаллическая решетка, в которой каждый атом окружен другими атомами. В большинстве случаев атомы металлов образуют положительно заряженное ядро и электронное облако, состоящее из свободных электронов. Именно наличие свободных электронов является основным свойством металлов и определяет их высокую проводимость электричества и тепла.
В отличие от металлов, атомы неметаллов имеют более сложную и разнообразную структуру. Обычно они образуют молекулы, состоящие из двух или более атомов, связанных между собой. Внутри молекулы атомы связаны с помощью ковалентных связей, которые возникают при обмене электронами. Этот тип связи обусловливает большую химическую активность неметаллов, их способность образовывать разнообразные соединения.
Строение атомов металлов
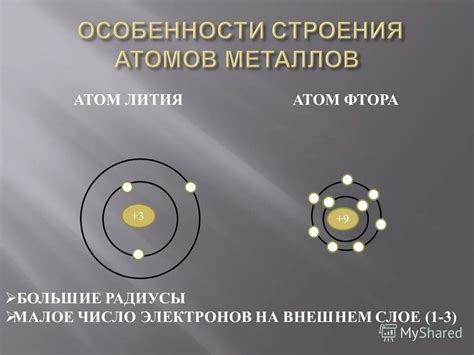
Атомы металлов отличаются от атомов неметаллов особенной структурой. В отличие от неметаллов атомы металлов имеют большой размер и слабо удерживают свои электроны. Это свойство делает их способными образовывать ионные соединения.
На внешнем энергетическом уровне атомы металлов обычно имеют малое количество электронов. Это позволяет им легко отдавать свои электроны и образовывать положительные ионы. Электроны в атоме металла располагаются по энергетическим оболочкам. На внутренних оболочках находятся зоны с положительно заряженными ядрами, а на внешней оболочке находятся электроны, которые могут легко передаваться другим атомам.
Атомы металлов также обладают высокой мобильностью своих электронов благодаря особенности их внутренней структуры. Их электроны могут свободно двигаться по кристаллической решетке металлов, что является основой их металлических свойств.
Строение атомов металлов влияет на их физические и химические свойства. В результате свободного движения электронов, металлы обладают хорошей теплопроводностью и электропроводностью. Также, благодаря легкости отдавать электроны, металлы образуют позитивные ионы, что делает их способными образовывать ионные соединения с отрицательно заряженными неметаллами.
Строение атома металла и его особенности

Атомы металлов имеют определенную структуру, которая отличается от строения атомов неметаллов. Одной из особенностей атомов металлов является наличие у них валентных электронов на внешнем энергетическом уровне. Возможность у внешнего энергетического уровня удерживать и отдавать электроны является причиной металлических свойств.
Неон (Ne) - металл, является хорошим примером металла, у которого на внешнем энергетическом уровне располагается 8 валентных электронов. Это обеспечивает стабильность атома и его способность образовывать кристаллическую решетку.
В металлах также присутствует внутренняя решетка, которая включает систему регулярно расположенных атомов. Эти атомы металлов образуют кристаллическую решетку, обладающую высокой степенью упорядоченности. Более того, атомы металлов имеют способность образовывать ионы положительного заряда путем отдачи электронов, что является одной из важных особенностей металлического строения.
Таким образом, строение атома металла характеризуется наличием валентных электронов на внешнем энергетическом уровне, формированием кристаллической решетки и способностью образовывать ионы положительного заряда. Эти особенности определяют металлические свойства металлов.
Строение атомов неметаллов
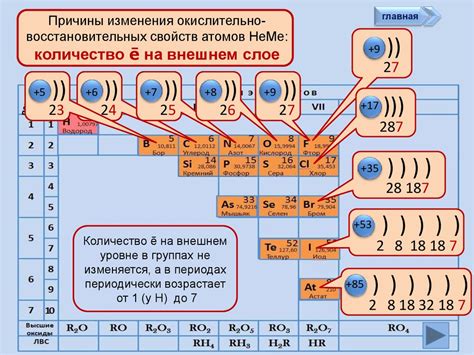
Неметаллы - это химические элементы, которые обладают плохой теплопроводностью, электропроводностью и обычно имеют газообразное или твердое состояние при комнатной температуре.
Строение атомов неметаллов отличается от строения атомов металлов. В отличие от металлических атомов, у неметаллов количество валентных электронов во внешней оболочке обычно меньше и стремится к заполнению. Это обусловлено тем, что неметаллы имеют большую электроотрицательность и большую силу притяжения электронов в своих атомах.
Атомы неметаллов могут образовывать ковалентные связи с другими атомами, обменявшись парой электронов. Это позволяет неметаллам образовывать структуры, в которых атомы связаны между собой посредством ковалентных связей, образуя молекулярные соединения.
Однако, у неметаллов есть ионное строение в виде положительно или отрицательно заряженных ионов. Например, атомы неметаллов могут заимствовать один или несколько электронов у других атомов, чтобы образовать отрицательно заряженные анионы, или отдать свои электроны и образовать положительно заряженные катионы.
Кроме того, в каждом неметаллическом веществе есть своя конкретная кристаллическая структура, которая определяется способом расположения атомов или молекул в пространстве. Знание строения атомов неметаллов позволяет понять их физические и химические свойства и объясняет различия в их поведении в химических реакциях и соединениях.
Строение атома неметалла и его особенности

Атом неметалла отличается от атома металла несколькими особенностями. Во-первых, атом неметалла обычно имеет меньшую массу, чем атом металла. Это связано с более высоким атомным номером и меньшим количеством протонов и нейтронов в ядре.
Во-вторых, атомы неметаллов обычно обладают более высокой электроотрицательностью, чем атомы металлов. Это означает, что они имеют большую способность притягивать электроны к своему ядру. Электроны в атомах неметаллов находятся ближе к ядру и образуют более плотные электронные облака.
Еще одной особенностью строения атома неметалла является наличие валентной оболочки, которая обычно состоит из нескольких энергетических уровней. Валентная оболочка содержит электроны, которые участвуют в химических реакциях и образуют химические связи с другими атомами.
Строение атома неметалла также может быть представлено в виде электронной конфигурации, которая описывает распределение электронов по энергетическим уровням и подуровням. Электронная конфигурация неметалла помогает понять его химические свойства и способность образовывать химические связи.
В целом, строение атома неметалла отличается от строения атома металла по массе, электроотрицательности, наличию валентной оболочки и электронной конфигурации. Эти различия определяют химические и физические свойства неметаллов и их способность образовывать соединения с другими элементами.
Отличия между строением атомов металлов и неметаллов
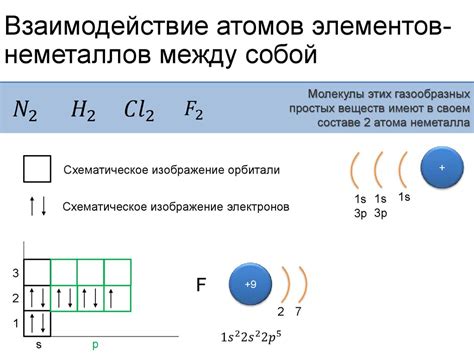
1. Электронная конфигурация: Основное отличие между атомами металлов и неметаллов заключается в их электронной конфигурации. Атомы металлов, как правило, имеют малое количество электронов в своей валентной оболочке и обычно отдают эти электроны при взаимодействии с другими элементами. В то время как атомы неметаллов, наоборот, имеют большее количество электронов в валентной оболочке и имеют тенденцию принимать электроны во время химических реакций.
2. Размер атома: Атомы металлов обычно имеют больший размер, чем атомы неметаллов. Это связано с тем, что атомы металлов имеют большее количество электронов и более широкую валентную оболочку, что приводит к более распространенному расположению электронов в пространстве.
3. Силы привлечения: Физические свойства металлов и неметаллов также различаются из-за различных сил привлечения между атомами. Металлы обычно обладают металлическим связыванием, которое характеризуется сильными привлекательными силами между положительно заряженными ядрами и свободно движущимися электронами. Неметаллы, наоборот, имеют ковалентную или ионную связь, которая характеризуется силами привлечения между отрицательно заряженными электронами и положительно заряженными ядрами.
4. Свойства соединений: Соединения металлов и неметаллов имеют совершенно разные свойства. Соединения металлов, такие как сплавы, обычно обладают высокой термической и электрической проводимостью, ковкостью и блеском. В то время как соединения неметаллов могут обладать непроводимостью тепла и электричества, хрупкостью и могут быть прозрачными или непрозрачными для света.
5. Химическая активность: Металлы и неметаллы сильно различаются по химической активности. Металлы, как правило, обладают высокой химической активностью и имеют тенденцию образовать ионные соединения, отдавая электроны. В то время как неметаллы могут образовывать ковалентные соединения, принимая электроны.
Вопрос-ответ

Какие различия можно выделить в строении атомов металлов и неметаллов?
Атомы металлов чаще имеют больше электронов на внешнем энергетическом уровне, что делает их склонными к потере электронов и образованию положительно заряженных ионов. В отличие от этого, атомы неметаллов имеют меньше электронов на внешнем энергетическом уровне, что делает их склонными к получению электронов и образованию отрицательно заряженных ионов.
Каковы причины различий в строении атомов металлов и неметаллов?
Один из основных факторов, определяющих различия в строении атомов металлов и неметаллов, - это их положение в периодической системе элементов. Металлы находятся слева от линии разделения в периодической системе, в то время как неметаллы - справа от нее. Это различие в положении обусловлено разными электронными конфигурациями и структурами атомных оболочек, что в свою очередь определяет разное химическое поведение элементов.
Какие металлы и неметаллы можно назвать примерами?
Примерами металлов являются железо, медь, алюминий, свинец и золото. Они характеризуются проводимостью электричества и тепла, а также обладают блестящей поверхностью. К неметаллам относятся кислород, сера, азот, фосфор и хлор. Они обычно не проводят электричество и тепло, а также могут иметь различные цвета и запахи.
Как строится атом металла?
Атом металла состоит из ядра, в котором находятся протоны и нейтроны, а также электронной оболочки. Ядро, обладающее положительным зарядом, находится в центре атома и содержит большую часть его массы. Вокруг ядра находятся электроны, движущиеся по энергетическим уровням. Внешний энергетический уровень атома металла обычно содержит меньшее количество электронов по сравнению со внутренними уровнями.
