Реакция металлов с азотной кислотой является одной из наиболее изученных и широко применяемых химических реакций. Азотная кислота (HNO3) – это сильная кислота, которая обладает окислительными свойствами. При взаимодействии с металлами она способна вызывать различные химические превращения.
Схема реакции металлов с азотной кислотой заключается в том, что металл реагирует с кислотой, образуя соответствующую соль и выделяя водород. Эта реакция можно представить следующим уравнением:
M + HNO3 → M(NO3)2 + H2
Где M обозначает металл. В результате реакции образуется соль металла и обычно выделяется газ водород. Однако, не все металлы взаимодействуют с азотной кислотой одинаково. Некоторые металлы легко растворяются в азотной кислоте, другие реагируют очень медленно или даже не реагируют вообще.
Особенностью реакции металлов с азотной кислотой является то, что в процессе реакции могут образовываться различные степени окисления металла, что влияет на химические свойства и внешний вид полученной соли. Для некоторых металлов также характерно образование пассивной пленки на поверхности, что препятствует дальнейшей реакции с кислотой.
Металлы и азотная кислота

Взаимодействие металлов с азотной кислотой является одним из важных и широко изученных химических процессов. Азотная кислота (HNO3) является сильным окислителем и распространенным реагентом, который может взаимодействовать с различными металлами.
В результате реакции с азотной кислотой металлы могут образовывать свои нитраты. Образование нитратов связано с процессом окисления металла, при котором он отдает электроны азотной кислоте. Некоторые металлы, такие как медь и железо, реагируют с азотной кислотой более активно и образуют соответствующие нитраты.
Реакция между металлом и азотной кислотой протекает по следующей схеме: металл + азотная кислота = нитрат металла + оксиды азота + вода. Образование нитрата металла является основным результатом этой реакции.
Химическая реакция

Химическая реакция – это процесс, в результате которого происходит превращение одних химических веществ в другие. Она сопровождается изменением структуры и свойств исходных веществ. Химические реакции играют важную роль во многих областях науки и техники.
В химической реакции металлы могут взаимодействовать с азотной кислотой. Азотная кислота (HNO3) является сильным окисляющим агентом. При контакте металлов с азотной кислотой происходит окислительно-восстановительная реакция.
Реакция между металлом и азотной кислотой включает в себя несколько стадий. Сначала происходит образование нитратных солей металлов, например, нитрат калия (KNO3) или нитрат меди (Cu(NO3)2). При этом азотная кислота переходит в аммиак (NH3) и оксид азота (NO).
Важной особенностью реакции металлов с азотной кислотой является образование нитратной пленки на поверхности металла. Эта пленка предотвращает дальнейшее взаимодействие металла с окислителем и является защитой от коррозии. Однако, некоторые металлы, такие как магний, алюминий и цинк, могут быть растворены в азотной кислоте при достаточно высокой концентрации и длительном воздействии.
Образование нитратов

Реакция металлов с азотной кислотой приводит к образованию нитратов. Нитраты представляют собой соли азотной кислоты, в которых катионом выступает металл, а анионом - нитратный радикал (NO3-).
При взаимодействии металла с азотной кислотой происходит окисление металла и одновременное восстановление азотной кислоты. В результате этой реакции образуются соответствующие нитратные соли и выделяется обильное количество газообразного оксида азота.
Нитраты имеют особенности в своей структуре. Они образуют кристаллические соединения, обладающие высокой стабильностью и хорошей растворимостью в воде. Это делает нитраты удобными для использования в различных отраслях промышленности - в производстве удобрений, пищевой и химической промышленности, а также в медицине.
Нитраты имеют важное значение в биологических процессах. Они являются источником азота для многих живых организмов и необходимы для синтеза белков. Однако, высокая концентрация нитратов в питьевой воде может быть вредна для здоровья человека, поэтому их содержание регулируется нормативами и требует контроля.
Особенности реакции металлов с азотной кислотой в зависимости от типа металла
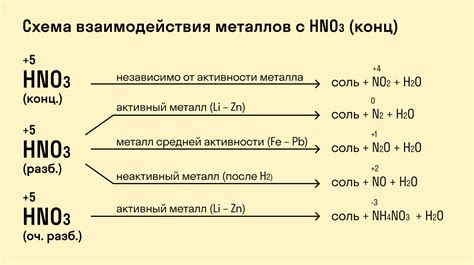
Реакция металлов с азотной кислотой является химическим процессом, который происходит при контакте металла с раствором азотной кислоты. Особенности этой реакции зависят от типа металла, его активности и концентрации азотной кислоты.
1. Активные металлы, такие как натрий, калий или магний, обладают способностью активно взаимодействовать с азотной кислотой. При этом происходит выделение газообразного продукта - оксида азота. Реакция сопровождается выделением тепла и иногда образованием шума и искр. Например, реакция натрия с азотной кислотой может протекать так:
- Na + HNO3 → NaNO3 + H2O + NO2
2. Некоторые металлы, такие как железо или алюминий, могут взаимодействовать с азотной кислотой только в присутствии катализаторов, таких как платина или железо(III) хлорид. В этом случае реакция может протекать медленнее и с выделением нитрозных оксидов.
3. Некоторые металлы, например серебро или медь, не реагируют с азотной кислотой, так как образуют прочную защитную пленку из соответствующих нитратов, которая не пропускает кислоту к металлу. Таким образом, эти металлы устойчивы к взаимодействию с азотной кислотой.
Реакция металлов с азотной кислотой является важным процессом в химической промышленности, ее применяют для получения различных продуктов, таких как нитраты и нитрозные оксиды. Знание особенностей реакции с различными металлами позволяет контролировать и оптимизировать процессы получения нужных продуктов.
Влияние концентрации азотной кислоты на реакцию

Концентрация азотной кислоты является одним из факторов, оказывающих влияние на ход реакции с металлами. Увеличение концентрации азотной кислоты приводит к ускорению процесса взаимодействия металла с кислотой.
При повышенной концентрации азотной кислоты увеличивается количество доступных ионов H+, которые могут вступать в реакцию с металлами. Это ускоряет процесс окисления металла и образования соответствующих солей.
Более высокая концентрация азотной кислоты также способствует более интенсивному образованию дыма и газов при взаимодействии с металлами. При этом выделяются оксиды азота, которые взаимодействуют с водой в окружающей среде и могут приводить к образованию азотных соединений.
Однако, стоит отметить, что слишком высокая концентрация азотной кислоты может вызывать более интенсивное выделение ядовитых газов, что может быть опасно при работе с данным веществом. Поэтому необходимо продуманно и осторожно проводить эксперименты с повышенной концентрацией азотной кислоты.
Таким образом, концентрация азотной кислоты играет важную роль в реакции с металлами. Она оказывает влияние на скорость реакции, образование дыма, газов и может повышать опасность работы с этим веществом. При проведении экспериментов необходимо учитывать и контролировать концентрацию азотной кислоты для достижения необходимого результата и безопасности процесса.
Вопрос-ответ

Каким образом происходит реакция металлов с азотной кислотой?
Реакция металлов с азотной кислотой происходит по следующей схеме: металл + HNO3 = NO2 + H2O + соль металла. В результате этой реакции образуется оксид азота, вода и соль металла. Некоторые металлы, такие как железо или алюминий, могут реагировать с азотной кислотой только при нагревании.
Какие металлы реагируют с азотной кислотой?
С азотной кислотой реагируют различные металлы, например железо, алюминий, цинк, медь, свинец и др. Каждый металл имеет свою скорость реакции с азотной кислотой. Некоторые металлы могут реагировать с азотной кислотой только при наличии хлорида железа(III).
