Щелочные металлы являются основными элементами в периодической системе химических элементов. Они включают литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы имеют характерные свойства, такие как низкая плотность, низкая температура плавления и высокая химическая реактивность.
Структура электронного строения щелочного металла основана на их электронной конфигурации. Каждый щелочный металл имеет один электрон в своей внешней оболочке. Этот электрон находится на самом удаленном энергетическом уровне от ядра атома, который называется s-подуровнем.
Благодаря наличию одного электрона во внешней оболочке, щелочные металлы легко образуют ион положительного заряда, отдавая этот электрон. Это обеспечивает высокую химическую реактивность и способность образовывать легко растворимые соединения, такие как гидроксиды и соли.
Структура кристаллической решетки щелочных металлов базируется на их электронной конфигурации. Кристаллическая решетка этого типа металлов характеризуется тем, что каждый металлический атом окружен шестью или восьми соседними атомами в форме регулярной трехмерной сетки. Это обеспечивает их высокую плотность и способность эффективного проводить электрический ток.
Атомный радиус и кристаллическая структура
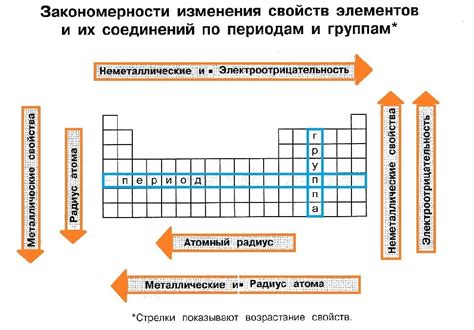
Атомный радиус щелочных металлов варьируется в зависимости от периода добываемого элемента и его положения в группе. В общем случае, атомы щелочных металлов имеют большой атомный радиус, что обусловлено низкой электронной плотностью. По химическим свойствам щелочные металлы весьма активны. В основном они реагируют с водой, кислородом, сероводородом, галогенами, серной кислотой и другими веществами. Данный факт связан с устойчивостью окислов щелочных металлов, которые легко образуются в ходе реакции с кислородом и водой.
Кристаллическая структура щелочных металлов также имеет свои особенности. Большинство щелочных металлов, включая литий, натрий, калий, рубидий и цезий, образуют кубически центрированные решетки. Это означает, что каждый атом окружен шестью ближайшими соседями, а также восемью соседями на большей расстоянии. Однако, атомы калия, рубидия и цезия также образуют гексагональные решетки. В таких системах, каждый атом окружен шестью ближайшими соседями, а также угловыми и диагональными соседями.
Для более подробного изучения кристаллической структуры щелочных металлов проводят рентгеноструктурный анализ. Этот метод позволяет определить расположение атомов в кристаллической решетке, а также рассчитать параметры ячейки. Анализ данных, полученных при рентгеноструктурном анализе, позволяет сделать выводы о взаимной ориентации атомов и их взаимодействии внутри кристалла щелочного металла.
Образование кристаллической решетки
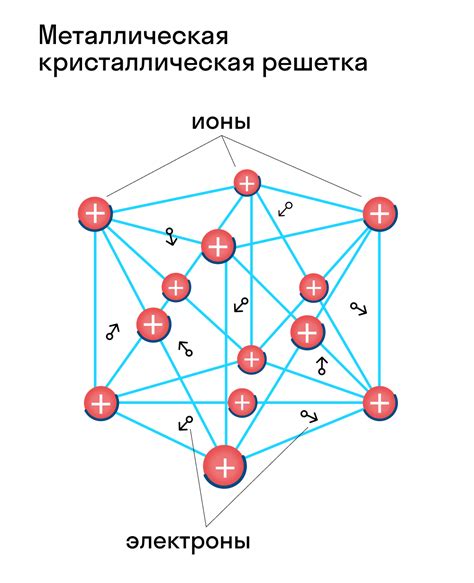
Щелочные металлы, такие как литий, натрий, калий и др., характеризуются особой структурой ионной решетки. Эта структура образуется благодаря взаимодействию положительно заряженных ионов металла с отрицательно заряженными электронными облаками. Образование кристаллической решетки щелочного металла происходит в результате обмена электронами и электростатического взаимодействия между ионами и электронами.
Ионы щелочных металлов обладают положительным зарядом, который привлекает отрицательно заряженные электронные облака. При сближении ионов и электронов происходит обмен электронами, в результате чего образуется кристаллическая решетка, которая представляет собой упорядоченную структуру ионов.
Структура кристаллической решетки щелочных металлов может быть представлена в виде трехмерной сетки, где положительно заряженные ионы занимают вершины кубов, а отрицательно заряженные электронные облака находятся между ионами. Эта упорядоченная структура обеспечивает прочность и устойчивость кристаллической решетки щелочного металла.
Формирование кристаллической решетки щелочного металла происходит при достижении определенной температуры и давления, при которых ионы и электроны могут свободно перемещаться и взаимодействовать друг с другом. Такая структура обеспечивает металлам свойство проводить электрический ток и обладать высокой пластичностью.
Устойчивые фазы щелочных металлов
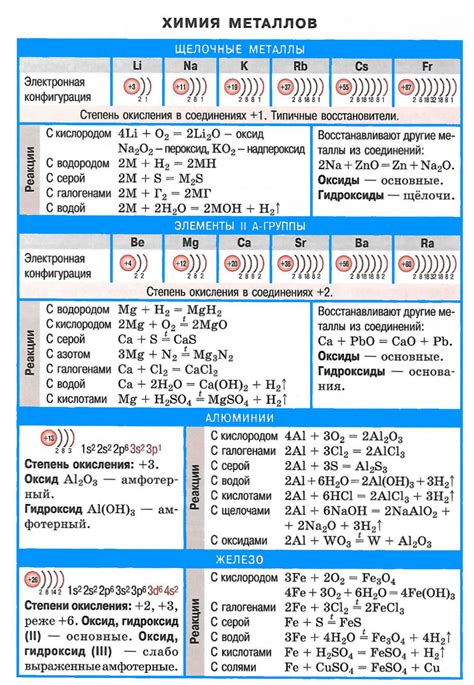
Устойчивые фазы щелочных металлов представляют собой специфическую структуру, которая обеспечивает устойчивость их электронного строения. Щелочные металлы обладают одним электроном в валентной оболочке, что делает их химически активными и склонными к образованию соединений с другими элементами.
Одной из наиболее распространенных устойчивых фаз щелочных металлов является кубическая решетка, известная также как кубическая граненая центрированная (гцц) решетка. В этой структуре атомы щелочных металлов располагаются в вершинах куба и в его центре, образуя кристаллическую решетку с высокой степенью симметрии.
Кубическая граненая центрированная решетка представляет собой устойчивую фазу, так как обеспечивает максимальное упаковывание атомов щелочных металлов и минимальное расстояние между ними. Это позволяет щелочным металлам образовывать прочные и стабильные соединения с другими элементами.
Кроме кубической граненой центрированной решетки, устойчивыми фазами щелочных металлов могут быть также гексагональная решетка, тетрагональная решетка и другие структуры. Каждая из этих фаз обладает своими особенностями и характерными свойствами, которые определяют их поведение в различных условиях.
Изучение устойчивых фаз щелочных металлов позволяет лучше понять их электронное строение и химические свойства. Это важно для разработки новых материалов и технологий, а также для понимания фундаментальных принципов химии и физики.
Основные характеристики электронной оболочки
Электронная оболочка щелочных металлов состоит из нескольких энергетических уровней, на которых находятся электроны. Ее основные характеристики включают количество электронов и их распределение по уровням.
Наиболее внешний энергетический уровень, называемый валентным, содержит один электрон. Валентные электроны имеют высокую энергию и участвуют в химических реакциях металла. Они легко участвуют в процессе обмена электронами с другими атомами, образуя ионы и обеспечивая металлу его активные химические свойства.
Ниже валентного уровня находятся более низкие энергетические уровни, на которых находится остальная часть электронов. Они образуют заполняющие электронные оболочки металла. Количество электронов в этих оболочках соответствует порядковому номеру элемента в периодической системе. Например, у лития на заполняющих оболочках находится 2 электрона, у натрия - 10 электронов, у калия - 18 электронов, и так далее.
Распределение электронов в электронной оболочке определяется закономерностями периодической системы элементов. Каждый энергетический уровень обладает определенным количеством подуровней, а каждый подуровень может вместить определенное количество электронов. Эти закономерности облегчают анализ и предсказание химических свойств щелочных металлов.
Химические свойства и вариации электронного строения

Химические свойства щелочных металлов во многом связаны с их электронным строением. Щелочные металлы обладают одноименной общей формулой оболочки электронов в валентной области – np^1, где n - главное квантовое число (1, 2, 3 и т.д.), p – буква, обозначающая атом с той или иной валентностью.
Благодаря своему электронному строению, щелочные металлы активно взаимодействуют с другими элементами и веществами. Они легко окисляются воздухом, реагируют с водой и многими кислотами. При этом электронный строение шелочных металлов предопределяет их способность образовывать стабильные соединения с электроотрицательными элементами.
Вариации электронного строения могут возникать в результате образования различных ионов щелочных металлов. Например, ион Лития (Li+) имеет электронное строение 1s^2, в то время как ион Калия (K+) имеет электронное строение 1s^2 2s^2 2p^6 3s^2 3p^6. Эти нюансы электронного строения приводят к различным химическим свойствам и возможностям реакций щелочных металлов с другими веществами.
Также стоит отметить, что электронное строение щелочных металлов и их химические свойства могут меняться в зависимости от условий окружающей среды. Например, под воздействием высоких температур или давления могут происходить изменения в электронном строении и изменение химических свойств вещества.
Особенности взаимодействия щелочных металлов с другими элементами

Реакционная способность. Щелочные металлы (литий, натрий, калий, рубидий и цезий) характеризуются высокой реакционной способностью. Они легко вступают в химические реакции с большинством других элементов.
Образование ионов. Взаимодействуя с другими элементами, щелочные металлы образуют положительно заряженные ионы. Например, литий образует ион Li+, натрий – ион Na+, калий – ион К+, рубидий – ион Rb+ и цезий – ион Cs+. Эти ионы обладают высокой атомной ионизацией и большой радиусом.
Образование солей. Щелочные металлы, взаимодействуя с кислотами, образуют соли. Например, при взаимодействии калия с хлоридной кислотой, образуется хлорид калия. Известны также соли, содержащие щелочные металлы, такие, как карбонаты, сульфаты, фосфаты и др.
Взаимодействие с кислородом. Щелочные металлы реагируют с кислородом воздуха, образуя оксиды. Например, натрий сгорает в кислороде, образуя оксид натрия (Na2O). Со взаимодействием кислорода щелочных металлов связана и их химическая активность.
Реакция с водой. Щелочные металлы реагируют с водой, образуя гидроксиды и выделяя водород. Например, взаимодействие калия с водой приводит к образованию гидроксида калия (KOH) и выделению водорода (H2). Реакция с водой является одной из характерных особенностей щелочных металлов.
- Взаимодействие с галогенами. Щелочные металлы образуют соединения с галогенами, такими, как фтор, хлор, бром и йод. Например, натрий реагирует с хлором, образуя хлорид натрия (NaCl).
- Восстановительные свойства. Щелочные металлы характеризуются выраженными восстановительными свойствами. Они способны передавать электроны другим элементам, участвуя в реакциях восстановления.
Образование сплавов. Щелочные металлы могут образовывать сплавы с другими металлами. Например, калий может образовывать сплавы с алюминием или натрием. Сплавы на основе щелочных металлов обладают различными физическими и химическими свойствами и широко используются в промышленности.
Роль электронной структуры в физических и химических свойствах
Электронная структура щелочных металлов, таких как литий, натрий и калий, играет ключевую роль в определении их физических и химических свойств. Одной из основных характеристик электронной структуры щелочных металлов является их электроотрицательность, которая определяет их способность отдавать электроны другим атомам.
Электронная структура влияет на многие физические свойства щелочных металлов, такие как температура плавления и кипения, плотность, теплопроводность и электропроводность. В частности, высокая мобильность электронов в щелочных металлах делает их отличными проводниками электричества и тепла. Это свойство обусловлено особенностями расположения электронов в энергетических уровнях атома щелочного металла.
Электронная структура также влияет на реакционную активность щелочных металлов. Благодаря низкой энергии ионизации, щелочные металлы легко теряют свои внешние электроны и образуют положительно заряженные ионы. Это позволяет им образовывать ионы со многими различными веществами и участвовать в химических реакциях. Например, щелочные металлы реагируют с водой, высвобождая водород и образуя щелочные гидроксиды.
Изучение электронной структуры щелочных металлов позволяет не только лучше понять их физические и химические свойства, но и применять их в различных областях, включая электронику, энергетику и космическую промышленность. Эти металлы широко используются как аккумуляторные батареи, катализаторы и конструкционные материалы.
Вопрос-ответ

Какова структура электронного строения щелочного металла?
Структура электронного строения щелочного металла характеризуется наличием одного внешнего электрона в самом высоком энергетическом уровне.
Что такое щелочные металлы и почему их электронное строение особенно?
Щелочные металлы - это химические элементы из первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Их электронное строение особенно тем, что у каждого из них есть только один внешний электрон. Это делает их очень активными в химических реакциях.
Каково значение внешнего электрона в электронном строении щелочного металла?
Внешний электрон в электронном строении щелочного металла имеет ключевое значение. Он легко участвует в химических реакциях, образуя ион с положительным зарядом. Это объясняет высокую реакционную активность щелочных металлов, их способность формировать ионы и соединения с другими элементами.
Можно ли изменить электронное строение щелочного металла?
Электронное строение щелочного металла фундаментально определяется его ядром и количеством нейтронов и протонов внутри него. Поэтому изменить его невозможно. Однако, в химических реакциях внешний электрон может быть потерян или принят, что приводит к образованию ионов и изменению электронного строения на уровне атома.
