Ковалентная связь – один из типов химической связи, которая образуется между атомами различных элементов. В случае связи между ионами металлов, образуются ковалентные связи, которые определяют многие физические и химические свойства металлических соединений.
Как известно, металлы обладают высокой электропроводностью, теплопроводностью и пластичностью. Все эти свойства обусловлены наличием свободных электронов в металлической решетке, которые могут двигаться по всей структуре материала. Ковалентная связь между ионами металлов играет ключевую роль в формировании этой структуры.
В металлической связи электроны внешней энергетической оболочки атомов металла делятся между всеми атомами в решетке. Каждый атом в решетке вносит свой вклад в образование ковалентных связей и электронов, тем самым создавая стабильную металлическую структуру.
Понимание ковалентной связи между ионами металлов позволяет улучшить прочность металлических материалов, увеличить их электропроводность и теплопроводность. Это имеет большое значение в различных областях промышленности, строительства и машиностроения.
Что такое ковалентная связь?
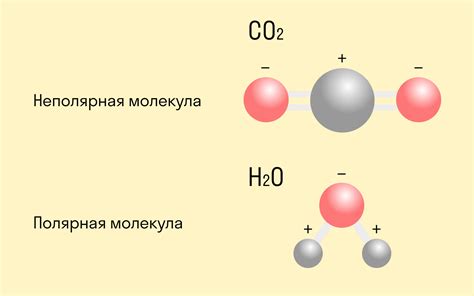
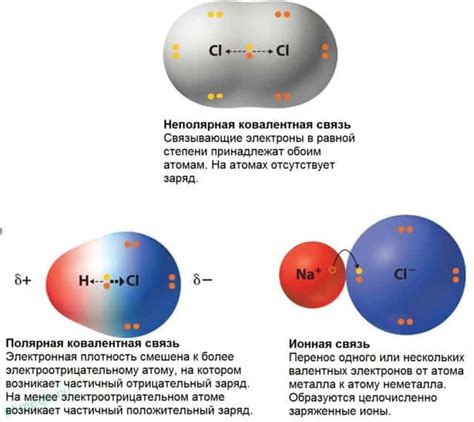
Ковалентная связь - это прочное взаимодействие между атомами, основанное на обмене электронами внешней электронной оболочки. Это одна из основных форм химической связи, которая происходит между атомами неметаллов или между атомом неметалла и металла.
Когда атомы образуют ковалентную связь, они делят электроны, чтобы достичь электронной конфигурации с полностью заполненной внешней оболочкой. В результате обмена электронами образуются сопряженные атомы, называемые молекулами. Ковалентную связь можно считать более сильной, чем ионную или металлическую связь.
Ковалентная связь может быть полярной или неполярной в зависимости от того, как электроны распределяются между атомами. В полярной ковалентной связи электроны могут быть смещены в сторону одного из атомов, создавая неравномерное распределение заряда. В неполярной ковалентной связи электроны равномерно распределены между атомами.
Ковалентная связь имеет важное значение в химии, поскольку она определяет свойства и структуру молекул. Она позволяет образовывать различные химические соединения и участвует в множестве химических реакций. Ковалентная связь также обеспечивает стабильность молекулы и позволяет ей существовать в различных состояниях вещества, таких как твердое, жидкое или газообразное.
Определение и основные принципы
Ковалентная связь между ионами металлов - это тип химической связи, образующийся между ионами металлов, в результате которого происходит обмен электронами. Основной принцип этой связи заключается в том, что ионы металлов, имеющие положительный заряд, притягивают к себе электроны от ионов другого металла с отрицательным зарядом.
В результате этого обмена электронами, образуется ковалентная связь между ионами металлов. Ковалентная связь является достаточно сильной связью, которая обуславливает устойчивость и прочность структуры кристаллической решетки вещества.
Основные принципы образования ковалентной связи между ионами металлов включают в себя несколько этапов. На первом этапе происходит ионизация металла, в результате которой образуются положительно заряженные ионы. На втором этапе происходит положительные ионы притягивают отрицательные ионы, передающие им электроны, в результате чего происходит образование ковалентной связи.
Важно отметить, что ковалентная связь между ионами металлов является ключевой для образования многих важных соединений, таких как соли, оксиды и металлокомплексы. Эта связь обуславливает особые химические и физические свойства металлов и позволяет им образовывать разнообразные структуры и соединения.
Ковалентная связь между ионами
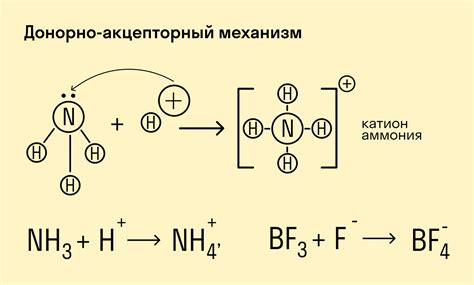
Ковалентная связь между ионами возникает при взаимодействии положительно заряженного иона (катиона) металла с отрицательно заряженным ионом (анионом) неметалла. В химии ковалентная связь относится к обменной связи, при которой электроны распределяются между атомами ионов.
Когда катион идеально соответствует аниону, то такая связь ковалентной называется ионно-координатной. В молекуле ионно-координатной связью каждый атом является как катионом, так и анионом одновременно. Такая связь проявляет включение междуатомных связей, формирующих цельный агрегат.
Возникновение ковалентной связи между ионами зависит от их зарядов и размеров. Чем больше заряды ионов, тем сильнее связь. Размеры ионов влияют на длину связи. Ковалентная связь между ионами является более сильной и устойчивой, чем ионная связь. Благодаря этому, вещества соединений между ионами имеют более высокую температуру плавления и кипения, чем ионные соединения.
Важность ковалентной связи для химических реакций
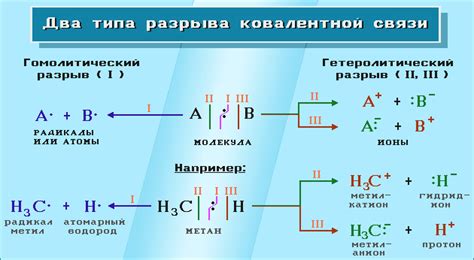
Ковалентная связь между ионами металлов играет важную роль в процессах химических реакций. Она обеспечивает стойкость и прочность структурных единиц вещества.
В первую очередь, ковалентная связь позволяет образование стабильных соединений между ионами металлов и неметаллов. Это обуславливает способность вещества к участию в различных химических реакциях, таких как окисление, восстановление, замещение и др.
Ковалентные связи также обеспечивают эффективную передачу электронов между ионами металлов, что позволяет образовывать ионы разной валентности и, следовательно, разнообразные соединения.
Кроме того, ковалентная связь влияет на физические и химические свойства вещества. Она определяет его температуру плавления, теплопроводность, электропроводность, плотность и другие характеристики.
Таким образом, ковалентная связь между ионами металлов является необходимой для возникновения и протекания различных химических реакций, играет важную роль в стабильности соединений и определяет свойства вещества.
Роль металлов в ковалентной связи
Металлы играют важную роль в ковалентной связи благодаря своей особой электронной структуре. В металлической связи, которая является основой металлических материалов, электроны свободно движутся по всей структуре, формируя электронное облако.
Электроны в металле могут образовывать ковалентные связи с другими атомами металла или с атомами других элементов. Такие связи называются металлическими ковалентными связями. Они обеспечивают прочность и устойчивость металлов.
Металлические ковалентные связи особенно важны для образования сплавов. Это излишества металлических элементов, которые объединяются вместе и образуют новые материалы с уникальными свойствами. К примеру, железо и никель могут образовывать сплав под названием нейзиль, который является основным материалом в производстве магнитов высокой мощности.
Также, металлы способны формировать межметаллические ковалентные связи, когда электроны образуют связи между различными атомами металла. Это позволяет металлам образовывать сложные структуры, такие как кристаллические решетки.
Роль металлов в ковалентной связи важна для множества областей, включая металлургию, электронику, строительство и многое другое. Металлические материалы с их уникальными свойствами являются основой современных технологий и инноваций.
Типы металлических связей
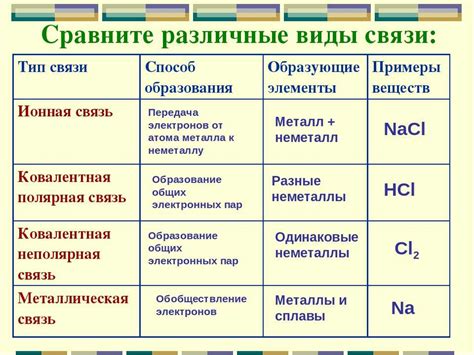
Металлические связи представляют собой особую форму связи между атомами металлов. В зоне проводимости металлической сетки электроны образуют электронный газ, который взаимодействует с положительно заряженными ионами металла. Существует несколько различных типов металлических связей, которые определяют физические и химические свойства металлов.
1. Связь на основе сильного межатомного взаимодействия: Этот тип связи характерен для щелочных и щелочноземельных металлов. В данном случае, электроны сильно взаимодействуют с положительно заряженными ядрами металла, что делает связь очень прочной. Такая связь обладает хорошей электропроводностью и теплопроводностью.
2. Связь на основе металлической или ковалентной связи: Этот тип связи обычно присутствует в переходных металлах. Он сочетает свойства обеих связей: сильного межатомного взаимодействия и обмена электронами. Это позволяет переходным металлам образовывать различные структуры с разными степенями электропроводности и теплопроводности.
3. Связь на основе гибридизации энергетических уровней: Для некоторых металлов, образующих очень низкие энергетические уровни, связь может быть основана на гибридизации этих уровней. В данном случае, электроны перемещаются между гибридными орбиталями различных энергетических уровней, что определяет их свойства.
Понимание различных типов металлических связей имеет важное значение для изучения физических и химических свойств металлов. Это позволяет предсказывать и объяснять их поведение в различных условиях и применять их в различных промышленных и научных областях.
Примеры ковалентной связи между ионами металлов

Ковалентная связь между ионами металлов возникает, когда два или более атома металла образуют молекулу, в которой они делят электроны. Это связь, в которой электроны распределены между атомами металла и придают им стабильность и прочность.
Один из примеров ковалентной связи между ионами металлов - молекула кислорода (O2). Два атома кислорода делят между собой электроны, образуя двухатомную молекулу. При этом оба атома металла получают полные внешние электронные оболочки и становятся более стабильными.
Другим примером ковалентной связи между ионами металлов является молекула хлора (Cl2). В этом случае, два атома хлора образуют молекулу, делая общий вклад в образование связи. Они делят между собой пару электронов, что обеспечивает стабильность молекулы.
Также можно привести пример ковалентной связи между ионами металла и неметалла. Например, молекула воды (H2O) образуется в результате связи атома кислорода (металла) и двух атомов водорода (неметалла). В этом случае, электроны делятся между атомами, образуя общую связь и придавая молекуле стабильность.
Вопрос-ответ

Какие металлы могут образовывать ковалентную связь с ионами?
Ковалентная связь между ионами металлов может образовываться с разными металлами, но наиболее распространена она с металлами из d- и f-блоков периодической системы.
Как можно охарактеризовать ковалентную связь между ионами?
Ковалентная связь между ионами характеризуется сильным взаимодействием электронных оболочек ионов. В такой связи ионы металла обмениваются электронами, причем эти электроны находятся между ионами и взаимодействуют с обоими.
Каковы особенности ковалентной связи между ионами металлов?
Одной из особенностей ковалентной связи между ионами металлов является ее направленность. Также стоит отметить, что в ковалентной связи между ионами энергия связи между ионами металла будет зависеть от размеров ионов, зарядов ионов и силы электронного облака ионов.
