Взаимодействие атомов в металлах определяет их свойства и поведение. У металлов особая внутренняя структура, которая отличается от структуры других типов веществ. Одним из ключевых аспектов этой структуры является способ, которым атомы взаимодействуют друг с другом в металлической решетке.
Металлическая связь – это основной механизм взаимодействия атомов металлов. Она основана на обмене электронами между атомами. Особенностью металлической связи является наличие так называемых «свободных электронов», которые перемещаются по всей металлической структуре. Эти свободные электроны являются ответственными за электрическую и тепловую проводимость металлов, а также за их блеск и металлический глянец.
Металлическая решетка образует кристаллическую структуру, в которой атомы металлов упакованы в определенном порядке. Кристаллическая структура металлов имеет регулярную сетку, в которой каждый атом занимает строго определенное положение. Такая упаковка атомов обеспечивает металлам их твердость и прочность.
Взаимодействие атомов металлов – это сложный и многогранный процесс, который определяет уникальные свойства металлической структуры. Понимание этого механизма позволяет разрабатывать новые материалы с улучшенными свойствами и областью применения.
Механизм взаимодействия атомов металлов
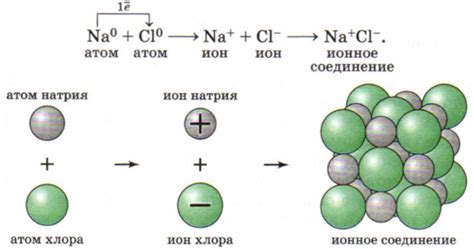
Взаимодействие атомов металлов играет важную роль в формировании их свойств и кристаллической структуры. Это взаимодействие определяется связью между атомами, которая основывается на их электронной структуре.
Большинство атомов металлов имеют от одного до нескольких электронов в своей валентной оболочке. Эти электроны, называемые валентными электронами, легко перемещаются между атомами металла. Именно эти свободные электроны делают металлы хорошими проводниками электричества и тепла.
Взаимодействие атомов металлов также определяется их общей энергией. Атомы металлов стремятся достичь наименьшей энергии путем максимального приближения друг к другу и образования стабильной кристаллической структуры.
Это взаимодействие атомов металлов может быть представлено в виде сетки, где каждый атом металла занимает определенную позицию в пространстве. В этой сетке атомы металла связаны между собой ближайшими соседями через связи, которые могут быть однородными или разнородными.
Механизм взаимодействия атомов металлов может варьироваться в зависимости от конкретного металла и его структуры. Например, в кубической решетке атомы металлов располагаются на вершинах и в центрах граней куба. В гексагональной решетке атомы металлов располагаются на вершинах и в центрах граней правильного шестиугольника.
Процесс формирования химических связей
Химическая связь между атомами металлов является основой для формирования кристаллической структуры металлов. Этот процесс начинается с взаимодействия электронов в валентной оболочке атомов металла.
Основным механизмом формирования химической связи между атомами металлов является обмен электронами. Атомы металла отдают или принимают электроны, чтобы достичь стабильной электронной конфигурации, в результате чего образуется электронный облако вокруг каждого атома, образующее связывающие между собой электроны. Эти связывающие электроны образуют так называемую "облако межатомных связей".
Процесс образования химических связей может приводить к образованию различных структур металлов, таких как кристаллическая решетка, аморфное состояние или сплавы. Кристаллическая структура металлов образуется при упорядоченном взаимодействии атомов металла в кристаллической решетке. В какой-то мере, структура кристаллической решетки зависит от типа и силы химических связей между атомами металлов.
Химические связи в металлах обладают рядом особенностей. В отличие от связей в молекулах, где есть четкие связи между конкретными атомами, в металлах электроны в облаке межатомных связей свободно перемещаются между атомами, образуя так называемую "электронную оболочку". Это позволяет металлам обладать определенными особенностями, такими как высокая теплопроводность, упругость и электропроводность.
Влияние химических связей на физические свойства
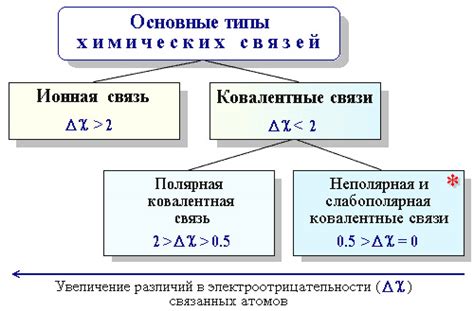
Химические связи между атомами вещества оказывают существенное влияние на его физические свойства. Как известно, химические связи классифицируются на ионные, ковалентные и металлические.
Наличие ионной связи в материале, обусловленной перемещением электронов между атомами, способствует появлению такого свойства, как электропроводность. Это объясняется возможностью подвижности ионов, что позволяет электрическим зарядам свободно перемещаться внутри материала.
Ковалентная связь, в свою очередь, характеризуется совместным использованием электронов атомами вещества. Этот тип связи определяет такие свойства, как твердость и прочность материала. За счет ковалентных связей атомы вещества становятся очень плотно связанными, что делает материал твердым и устойчивым к механическим воздействиям.
Металлическая связь, характерная для металлов, отличается тем, что атомы вещества обмениваются электронами между собой, образуя общую «электронную облако», которое обеспечивает их свободное движение. Это явление объясняет свойства металлов, такие как высокая теплопроводность и электропроводность.
Таким образом, химические связи между атомами оказывают существенное влияние на физические свойства материала. Ионная связь определяет электропроводность, ковалентная связь – твердость и прочность, а металлическая связь – теплопроводность и электропроводность.
Формирование кристаллической структуры
Формирование кристаллической структуры металлических материалов основывается на взаимодействии атомов, которые составляют металл. Эти атомы образуют упакованные циклические структуры, которые повторяются во всем кристалле. Кристаллическая структура определяет множество свойств металлов, таких как прочность, твердость и электропроводность.
Внутри кристалла атомы металла упаковываются максимально плотно и упорядоченно. Эта упаковка состоит из нескольких типов атомных плоскостей, которые повторяются в трех измерениях. Атомы находятся на определенных расстояниях друг от друга и имеют определенные направления взаимодействия.
В кристаллической структуре металла отдельные атомы соединены связями, называемыми ковалентными связями, и формируют трехмерную решетку. Ковалентные связи обеспечивают устойчивость кристаллической структуры и делают металлы прочными и твердыми.
Изменение температуры или приложение давления может вызывать деформацию кристаллической структуры. При деформации атомы передвигаются и принимают новое положение, что приводит к изменению свойств металла. Это явление называется пластической деформацией и позволяет металлам быть гибкими и формоизменяемыми.
Роль кристаллической структуры в свойствах металлов
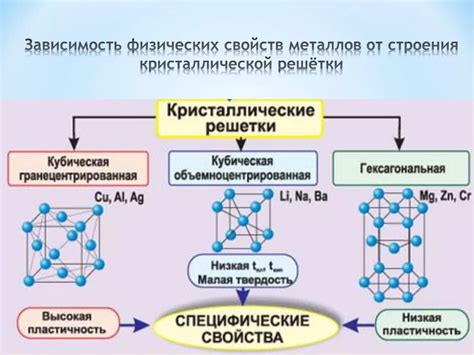
Кристаллическая структура играет ключевую роль в определении свойств металлов. Она формирует основу для их механических, термических и электрических характеристик. Кристаллическая структура металла образуется за счет регулярного расположения атомов в решетке.
Ориентация и форма металлической решетки непосредственно влияют на такие свойства, как прочность, упругость, пластичность и твердость металлов. Например, кристаллическая структура, состоящая из компактно упакованных атомов, может обеспечить высокую прочность и твердость материала.
Кристаллическая структура также влияет на термические свойства металлов, такие как теплопроводность и коэффициент теплового расширения. Регулярное расположение атомов в кристаллической решетке обеспечивает быстрый и эффективный перенос тепла через материал.
Кроме того, кристаллическая структура имеет значительное влияние на электрические свойства металлов. Некоторые металлы обладают высокой электрической проводимостью благодаря своей кристаллической структуре. Например, металлы с кубической решеткой, такие как медь или алюминий, обеспечивают высокую проводимость электричества.
В итоге, кристаллическая структура металлов играет существенную роль в их свойствах. Понимание и контроль над этой структурой позволяет разрабатывать металлические материалы с определенными характеристиками, что является важным аспектом в металлургии и инженерии материалов.
Вопрос-ответ

Какие типы связей существуют между атомами металлов?
Существует несколько типов связей между атомами металлов, включая ионную связь, ковалентную связь и металлическую связь. В ионной связи электроны передаются от металлического атома к неметаллическому атому, образуя положительные и отрицательные ионы, которые притягиваются друг к другу. В ковалентной связи электроны делятся между атомами, создавая общий электронный облако. Металлическая связь основана на обмене электронами между атомами металла.
Как связи между атомами металлов влияют на их кристаллическую структуру?
Взаимодействие между атомами металлов определяет кристаллическую структуру материала. Возникающая металлическая связь, в которой электроны передаются от одного атома к другому, позволяет металлическим атомам образовывать регулярную трехмерную структуру, состоящую из упорядоченной решетки. Ковалентные и ионные связи также влияют на кристаллическую структуру, определяя положение и взаимное расположение атомов в кристалле.
Какие факторы влияют на механизм взаимодействия атомов металлов?
Механизм взаимодействия атомов металлов зависит от нескольких факторов. Один из ключевых факторов - тип связи между атомами, который может быть ионным, ковалентным или металлическим. Кроме того, размер и заряд атомов, а также их расположение в кристаллической решетке, также оказывают влияние на взаимодействие и связь между атомами металлов.
Какие применения имеет понимание механизмов взаимодействия атомов металлов?
Понимание механизмов взаимодействия атомов металлов имеет широкий спектр применений. На основе этого понимания разрабатываются новые материалы с улучшенными свойствами, такие как прочность, эластичность, проводимость электричества и тепла. Это также помогает в разработке новых методов обработки и создания металлических материалов и сплавов, а также в понимании и улучшении кристаллической структуры металлов для различных технических применений.
