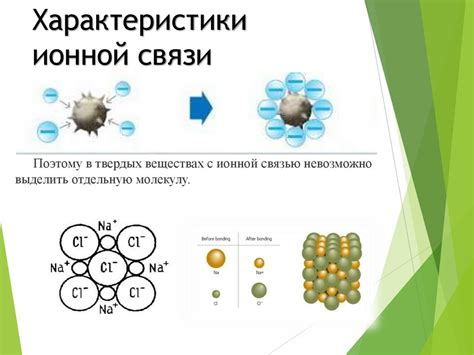
В химии существует множество типов связей между атомами, одним из которых является ионная связь. Она возникает между металлическими и неметаллическими элементами, когда между ними происходит перенос электронов. Ионная связь характеризуется тем, что между атомами образуются ионы с противоположными зарядами - катионы и анионы.
Металлы, обладающие низкой электроотрицательностью, обычно теряют свои внешние электроны и образуют положительно заряженные катионы. Неметаллы, наоборот, обладают высокой электроотрицательностью и готовы принять электроны, образуя отрицательно заряженные анионы.
Такой перенос электронов и образование ионов приводят к образованию межатомной связи. В отличие от ковалентной связи, где электроны являются общими для обоих атомов, в ионной связи электроны полностью передаются с одного атома на другой. Поэтому ионная связь обычно является очень прочной и требует большой энергии для разрыва.
В ионных соединениях, образующихся в результате ионной связи, атомы металлов и неметаллов образуют кристаллическую решетку. Катионы и анионы занимают устойчивые положения в этой решетке, образуя трехмерную структуру. Каждый ион притягивается к атомам с противоположным зарядом, что обусловливает мощную электростатическую притяжение и делает такое соединение прочным и твердым.
Ионная связь: понятие и принципы

Ионная связь - это тип химической связи, который формируется между атомами металлов и неметаллов. Основой ионной связи является образование ионов - атомов, которые приобретают положительный или отрицательный электрический заряд.
Принцип работы ионной связи основан на принципе электронного уровня. Атомы неметаллов, такие как кислород, хлор и фтор, имеют высокую электроотрицательность и имеют тенденцию принять электроны, чтобы заполнить свои внешние электронные оболочки.
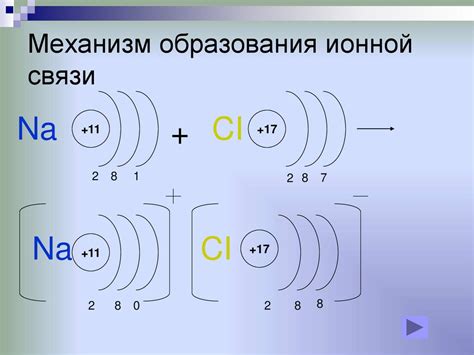
С другой стороны, атомы металлов, такие как натрий, калий и магний, имеют низкую электроотрицательность и имеют тенденцию отдавать электроны, чтобы освободить свои внешние электронные оболочки. Когда атомы металлов и неметаллов встречаются, атом неметалла забирает один или несколько электронов от атома металла, образуя отрицательно заряженный ион, называемый анионом, и положительно заряженный ион, называемый катионом.
Таким образом, образование ионной связи происходит благодаря притяжению между положительно и отрицательно заряженными ионами. Эта притяжение является очень сильным и обеспечивает стабильность и прочность ионной связи. Это объясняет, почему соединения с ионной связью обычно обладают высокой температурой плавления и кипения, а также являются твердыми или кристаллическими веществами при комнатной температуре.
Металлы: особенности ионной связи
Металлы – это элементы химической системы, обладающие способностью образовывать ионные связи с неметаллами. Ионная связь между металлами и неметаллами характеризуется передачей электронов с металла на неметалл, образуя положительно заряженные ионы металла и отрицательно заряженные ионы неметалла.
Одной из особенностей ионной связи в металлах является высокая электропроводность и теплопроводность. Это связано с наличием свободных электронов в металлической решетке, которые способны свободно перемещаться под воздействием электрического поля или теплового движения.
Особенностью ионной связи в металлах является их металлический блеск. Это связано с тем, что свободные электроны металла способны поглощать и переизлучать свет, создавая эффектное отражение света.
Также следует отметить, что металлические ионы имеют способность образовывать гигантские кристаллические структуры, обеспечивая прочность и твердость металлов. Это объясняется сильными ионными взаимодействиями между положительно заряженными ионами металла и отрицательно заряженными ионами неметалла.
Важной особенностью ионной связи в металлах является их способность образовывать сплавы. Сплав – это материал, состоящий из металлических элементов. Ионная связь между металлами обеспечивает возможность создания материалов с новыми свойствами и характеристиками, что является важным фактором для промышленности.
Неметаллы: влияние на ионную связь

Неметаллы играют важную роль в формировании ионной связи с металлами. Ионная связь возникает между атомами металлов и неметаллов, когда неметаллы отдают или принимают электроны от металлов, образуя ионы положительного и отрицательного заряда.
Химические свойства неметаллов существенно влияют на силу и стабильность ионной связи. Неметаллы с высокой электроотрицательностью имеют большую способность принимать электроны, что приводит к образованию ионов отрицательного заряда (анионов). Это усиливает ионную связь, делая ее более стабильной и сильной.
Неметаллы также могут образовывать большое количество связей с металлами, что способствует образованию сложных кристаллических структур ионных соединений. Ионная связь с неметаллами обеспечивает устойчивость металлическим катионам, а также может влиять на их физические и химические свойства, такие как плавление, качественные характеристики растворимости и т. д.
Однако неметаллы могут также ослаблять ионную связь. Например, неметаллы со слабой электроотрицательностью могут трудно принимать электроны, что приводит к образованию менее стабильных ионов и слабой ионной связи. Это может влиять на ряд физических и химических характеристик, таких как температура плавления и испарения, растворимость и т. д.
Электроотрицательность: ключевой фактор ионной связи
Электроотрицательность является одним из ключевых факторов, определяющих формирование ионной связи между металлами и неметаллами. Электроотрицательность – это мера способности атома притягивать к себе электроны в химической связи. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны к себе.
При образовании ионной связи между металлом и неметаллом, один атом (обычно металла) отдает электроны другому атому (обычно неметалла). Электроотрицательность металла в таком случае является низкой, поскольку металл обычно имеет малое притяжение к электронам. Неметалл же, имеющий высокую электроотрицательность, притягивает электроны, переданные металлом, и в результате образуются ионы с положительным и отрицательным зарядами.
Изменение электроотрицательности между атомами металла и неметалла является важным фактором в определении степени полярности ионной связи. Если разница в электроотрицательности между атомами составляет 1,7 и выше по шкале Полинга, связь между ними является ионной и имеет полярность. Чем больше разница в электроотрицательности, тем более полярной будет связь.
Электроотрицательность является полезным инструментом для предсказания типа химической связи и определения ее характера. На основе значений электроотрицательности можно сравнивать связи между различными элементами и понимать, почему некоторые соединения между металлами и неметаллами образуются, а другие – нет.
Примеры ионных соединений

Важной группой ионных соединений являются соли. Наиболее широко известными солями являются хлориды, сульфаты, нитраты и карбонаты.
Примеры хлоридов:
- Хлорид натрия (NaCl) - основной компонент кухонной соли;
- Хлорид кальция (CaCl2) - используется в медицине и промышленности;
- Хлорид железа (FeCl3) - применяется в химическом производстве и водоочистке.
Примеры сульфатов:
- Сульфат магния (MgSO4) - используется в медицине и сельском хозяйстве;
- Сульфат цинка (ZnSO4) - применяется в производстве удобрений;
- Сульфат железа (FeSO4) - используется в медицине и в производстве красителей.
Примеры нитратов:
- Нитрат калия (KNO3) - используется в пищевой промышленности и взрывчатых веществах;
- Нитрат аммония (NH4NO3) - применяется в удобрениях и картофельном производстве;
- Нитрат меди (Cu(NO3)2) - используется в химическом производстве и пиротехнике.
Примеры карбонатов:
- Карбонат натрия (Na2CO3) - используется в стекольной промышленности и моющих средствах;
- Карбонат кальция (CaCO3) - применяется в строительстве и производстве цемента;
- Карбонат железа (FeCO3) - используется в производстве красок и керамики.
Это лишь небольшой перечень ионных соединений, которые могут образовываться при межатомной связи между металлами и неметаллами. Ионные соединения широко используются в различных областях человеческой деятельности, от применения в медицине и промышленности до использования в пищевой промышленности и строительстве.
Вопрос-ответ

Что такое ионные связи?
Ионные связи - это связи, которые возникают между металлами и неметаллами в соединениях. В этом типе связи один атом переходит на другой атом, образуя положительный и отрицательный ионы, которые притягиваются друг к другу.
Как происходит образование ионных связей?
Образование ионных связей происходит путем передачи электронов от одного атома к другому. Атомы металла отдают электроны и становятся положительно заряженными ионами, а атомы неметалла принимают эти электроны и становятся отрицательно заряженными ионами. Положительные и отрицательные ионы притягиваются друг к другу, образуя ионную связь.
Какие свойства характерны для соединений с ионной связью?
Соединения с ионной связью обычно имеют высокую температуру плавления и кипения, так как ионные связи являются крепкими. Они также обладают хорошей электропроводностью в расплавленном состоянии или в растворе, так как ионы могут свободно двигаться и переносить заряд. Кроме того, соединения с ионной связью обычно растворяются в воде.
Какие материалы образуют ионные связи?
Ионные связи образуются между металлами и неметаллами. Примерами материалов, образующих ионные связи, являются хлорид натрия (NaCl), оксид магния (MgO) и фторид кальция (CaF2).
