Металлическая связь - это тип химической связи, характерный для металлов. Она образуется между атомами металла и определяет их особенности в структуре и свойствах.
Общие электронные пары

Одним из ключевых свойств металлической связи является наличие общих электронных пар. Каждый атом металла имеет несколько электронов в своей внешней оболочке, которая называется валентной оболочкой. В процессе образования металлической связи внешние электроны металлических атомов становятся общими для всех атомов вещества.
Металлическое вещество состоит из кристаллической решетки, в которой металлические атомы расположены в регулярном порядке. Каждый атом окружен множеством других атомов, с которыми он имеет общие электронные пары. Эти электроны движутся свободно по решетке, создавая так называемое "море электронов".
Общие электронные пары играют важную роль в свойствах металлов. Они ответственны за высокую проводимость и теплопроводность металлов, а также их способность приобретать форму путем деформации без разрушения.
Металлы могут образовывать различные структуры на основе общих электронных пар. Например, вещества с простой кубической, гексагональной или кубической густой упаковкой атомов обладают различными свойствами. Общие электронные пары оказывают влияние на многочисленные физические и химические свойства металлов.
Таким образом, общие электронные пары обеспечивают особую структуру и свойства металлов. Они играют важную роль в формировании легированных сплавов, которые имеют различные свойства в зависимости от добавленных легирующих элементов. Металлическая связь и общие электронные пары являются основными факторами, обуславливающими уникальные свойства металлов.
Основные свойства металлических связей
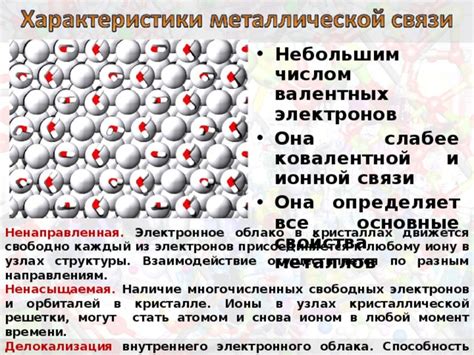
1. Проводимость: Металлические связи отличаются высокой проводимостью электричества. Это связано с наличием свободных электронов, которые могут свободно перемещаться по кристаллической решетке металла. Благодаря этому, металлы являются отличными проводниками электрического тока.
2. Подвижность: Металлические связи обладают высокой подвижностью. Это связано с тем, что электроны могут легко передаваться от одного атома к другому в металлической решетке. Благодаря этому, металлы обладают высокой теплопроводностью и могут быть легко подвергнуты деформации.
3. Металлический блеск: Металлы обладают характерным блеском, который связан с особенностями их электронной структуры. Свободные электроны поглощают и испускают свет, что придает металлам блеск и металлический вид.
4. Избирательность при восстановлении: Металлические связи способны восстанавливать ионные соединения. Это означает, что металл может отдавать свои электроны и восстанавливать другие ионы, что обеспечивает устойчивость его соединений.
5. Плавление и кипение: Металлические соединения имеют высокие точки плавления и кипения. Это обусловлено сильными металлическими связями, которые требуют большого количества энергии для разрушения кристаллической решетки.
6. Сплавляемость: Металлы могут быть легко сплавлены, то есть смешаны друг с другом. Это связано с тем, что электронные облака в металле могут перемещаться между атомами различных металлов, образуя стабильные связи.
Вопрос-ответ

Зачем атомы образуют связи?
Атомы образуют связи, чтобы достичь более стабильного энергетического состояния. Взаимодействие атомов позволяет им распределить электроны и образовать более устойчивые общие электронные пары.
Что такое общие электронные пары?
Общие электронные пары - это электроны, которые орбитально располагаются внутри валентной оболочки двух атомов. Они образуются в результате обмена электронами между атомами и являются основой для образования химических связей между атомами.
Как образуются металлические связи?
Металлические связи образуются между металлическими атомами. В металлах валентные электроны слабо связаны с отдельными атомами и могут свободно перемещаться по всей структуре. Это создает электронный «облако» или «море» вокруг атомов и позволяет металлам обладать хорошей электропроводностью и пластичностью.
