Щелочные металлы, такие как литий, натрий, калий и др., обычно считаются самыми активными металлами. Они имеют низкую плотность, низкую температуру плавления и являются отличными проводниками тепла и электричества. Однако, среди щелочных металлов есть исключение, которое проявляет себя в легкой окисляемости на воздухе.
Это исключение – литий. Литий – самый легкий из щелочных металлов. В чистом виде литий имеет серебристо-белый цвет и мягкую текстуру. Он очень реактивен и энергично взаимодействует с кислородом из воздуха, образуя покрытие оксида лития на поверхности. Эта реакция проходит очень быстро и сопровождается выделением тепла, что делает литий опасным и огнеопасным веществом.
«Малейший контакт лития с воздухом может вызвать пожар» – предупреждают специалисты.
Окисление лития происходит с высвобождением горючих газов и тепла. Поэтому хранение и обработка лития требуют особых мер предосторожности. Литиевые компоненты, такие как литиевые батареи, широко используются в современных электронных устройствах, благодаря своим уникальным свойствам. Однако, из-за легкой окисляемости литийных элементов необходимо соблюдать определенные правила безопасности, чтобы избежать возгорания или взрыва.
Исключение среди щелочных металлов:
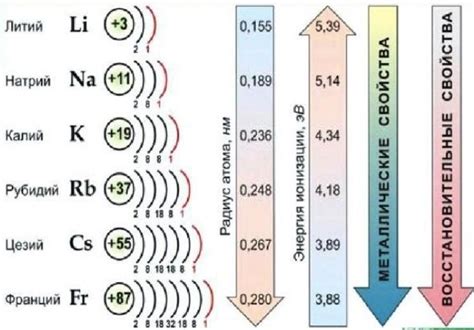
Среди щелочных металлов, таких как литий, натрий, калий, рубидий, цезий и франций, есть один элемент, который выделяется своими особенностями - литий. Литий является самым легким и активным металлом из этой группы.
Одной из главных характеристик лития является его обильное окисление на воздухе. В отличие от других щелочных металлов, литий очень легко реагирует с кислородом из воздуха, образуя оксид лития (Li2O). Это связано с тем, что литий имеет наименьшую электроотрицательность среди щелочных металлов, что делает его более склонным к электрохимическим реакциям.
Исключительная легкая окисляемость лития на воздухе связана с его строением и свойствами. Литий имеет наименьший атомный радиус среди щелочных металлов, что делает его атомы более доступными для взаимодействия с молекулами кислорода. Кроме того, литий обладает самым низким плавящимся металлическим оксидом, что позволяет ему легко реагировать с кислородом даже при низких температурах.
Таким образом, литий является исключением среди щелочных металлов своей легкой окисляемостью на воздухе. Это свойство делает его весьма реакционноспособным и требует особых условий хранения и использования.
Уникальная легкая окисляемость на воздухе

Среди всех щелочных металлов, легкая окисляемость на воздухе является уникальной характеристикой, которая отличает их от других элементов. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой химической активностью и склонны к реакциям с кислородом.
Эта уникальная характеристика щелочных металлов обусловлена их электронной структурой. Щелочные металлы имеют одну валентную электронную оболочку, что делает их сильными восстановителями. При взаимодействии с кислородом они отдают свою валентную электрон в процессе окисления и образуют окиси.
Легкая окисляемость на воздухе позволяет щелочным металлам проявлять яркую химическую реакцию с окружающей средой. При контакте с воздухом они сразу образуют окисные пленки, которые защищают металлы от дальнейшего окисления. Именно благодаря этим окисным пленкам и возникает яркий цвет щелочных металлов, так как они поглощают и отражают свет.
Однако, несмотря на защитные окисные пленки, щелочные металлы реагируют с влагой и воздушным кислородом, что приводит к их деградации. Поэтому, щелочные металлы хранятся в специальных контейнерах или хранятся под слоем покрытий, которые предотвращают контакт с кислородом и влагой.
Природа легкой окисляемости

Легкая окисляемость щелочных металлов на воздухе обусловлена их высокой активностью, вызванной электрохимической природой этих элементов. Особую роль в процессе окисления играет взаимодействие с водой и кислородом из воздуха.
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают одной электронной оболочкой в валентной зоне, что делает их химически активными. В результате взаимодействия с водой, металлы образуют гидроксиды, выделяя большое количество теплоты. Это явление называется гидролизом.
Кроме того, щелочные металлы реагируют с кислородом из воздуха, образуя оксиды металлов. Окисление лития протекает аналогично механизму горения: литий нагревается до определенной температуры, после чего он взрывается при контакте с воздухом. Натрий и калий также окисляются воздухом, образуя соответствующие оксиды.
Исключение среди щелочных металлов составляет цезий, который не реагирует с кислородом из воздуха при обычных условиях. Это связано с тем, что цезий имеет наиболее низкую электроотрицательность среди всех щелочных металлов, что делает его менее активным в химических реакциях.
Реакция с кислородом

Щелочные металлы, включая литий, натрий, калий, рубидий и цезий, обладают высокой реакционной способностью с кислородом. При контакте с воздухом, они активно взаимодействуют с кислородом, что приводит к образованию оксидов щелочных металлов.
Реакция с кислородом происходит с выделением значительного количества теплоты. Это связано с тем, что окисление металлов сопровождается высвобождением энергии. Результатом реакции с кислородом являются оксиды металлов, которые в большинстве случаев образуют кристаллические соединения.
Оксиды щелочных металлов обладают различными свойствами. Например, литийоксид является бесцветным и легким соединением. Натрийоксид имеет красно-бурую окраску и образует кристаллическую структуру. Калийоксид обладает высокой теплопроводностью и желтоватой окраской. Рубидийоксид и цезийоксид также образуют кристаллические соединения с различными физическими свойствами.
Влияние окружающей среды

Окружающая среда оказывает значительное влияние на свойства щелочных металлов, в частности на их окисляемость на воздухе. Щелочные металлы, такие как литий, натрий, калий и др., имеют высокую реакционную способность и легко окисляются. Однако, в зависимости от условий окружающей среды, их окисляемость может значительно изменяться.
Вода является одним из факторов окружающей среды, которая может влиять на окисляемость щелочных металлов. Когда щелочный металл попадает в контакт с водой, происходит быстрая реакция, в результате которой образуется щелочное гидроксидное соединение и выделяется водород. Это явление объясняется тем, что щелочные металлы имеют высокую электроотрицательность, что позволяет им легко отдавать электроны воде и образовывать ионы гидроксида.
Кроме того, воздух также оказывает существенное влияние на окисляемость щелочных металлов. При контакте с воздухом щелочные металлы могут начать окисляться и образовывать соединения с кислородом. Данный процесс может протекать достаточно быстро, особенно в случае повышенной влажности или наличия кислорода высокой концентрации. В результате окисления щелочных металлов на их поверхности может образовываться оксидная пленка, которая может замедлять процесс дальнейшей окисляемости.
Окисление влажным воздухом
Щелочные металлы, такие как литий, натрий и калий, обладают уникальным свойством легкой окисляемости на воздухе, особенно в присутствии влаги.
Реакция с влажным воздухом приводит к образованию оксидов щелочных металлов. Например, литий при взаимодействии с водой в атмосфере образует оксид лития (Li2O), который может быть затем превращен в гидроксид лития (LiOH) в результате взаимодействия с диоксидом углерода (CO2) в воздухе. Реакции окисления щелочных металлов происходят с выделением тепла и образованием щелочных гидроксидов.
Окисление влажным воздухом является опасным процессом для щелочных металлов, поскольку поверхность металла может покрываться окисной пленкой, которая мешает дальнейшим реакциям и защищает металл от окисления. Однако при повышенной влажности воздуха окисная пленка может разрушаться и окисление материала продолжится. Поэтому щелочные металлы обычно хранят в специальных упаковках или в инертной атмосфере для предотвращения воздействия влаги.
Окисление воздухом при высоких температурах
Одной из характерных особенностей щелочных металлов является их легкая окисляемость на воздухе. При высоких температурах этот процесс может происходить еще более интенсивно. Самыми реактивными из щелочных металлов являются калий и натрий.
Когда калий или натрий подвергаются воздействию высоких температур, они начинают реагировать с кислородом из воздуха. В результате образуется соответствующий оксид металла. Например, когда калий окисляется, образуется серовато-белый оксид калия (K2O).
Также стоит отметить, что при нагревании щелочных металлов воздух может происходить и другие реакции. Например, возможно образование пероксидов или супероксидов. Они обладают более сложными формулами и могут иметь более сложные свойства.
Важно учитывать, что окисление воздухом при высоких температурах может привести к образованию взрывоопасных соединений и реакций. Поэтому при работе с щелочными металлами следует соблюдать особые меры предосторожности и производить их хранение и транспортировку в соответствии с требованиями безопасности.
Чем опасна окисляемость

Окисляемость щелочных металлов на воздухе является серьезной проблемой и может иметь опасные последствия. Щелочные металлы, такие как литий, натрий и калий, легко взаимодействуют с кислородом в воздухе и образуют окисленные соединения.
Одно из самых известных последствий окисляемости щелочных металлов на воздухе - возможность их воспламенения при контакте с кислородом. При окислении щелочных металлов образуются оксиды, которые могут реагировать с влагой в воздухе и выделяться в виде горючих газов. Это может привести к возникновению пожара или взрыва.
Кроме того, окисляемость щелочных металлов может вызывать коррозию и разрушение металлических конструкций и оборудования. Оксиды щелочных металлов обладают высокой щелочностью, что может приводить к образованию агрессивных щелочных растворов. При контакте с металлическими поверхностями эти растворы способны вызывать коррозию и разрушение материала.
Окисляемость щелочных металлов также может привести к серьезным последствиям для живых организмов. Оксиды и соединения щелочных металлов являются едкими и токсичными. При попадании на кожу или в дыхательные пути они могут вызвать ожоги, раздражение или отравление организма. Поэтому необходимо соблюдать осторожность и работать с щелочными металлами только в специальных условиях и с защитными средствами.
Примеры использования щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкий спектр применений в различных отраслях науки, технологии и промышленности.
1. Литий: Литий широко используется в производстве аккумуляторов, особенно литиевых ионных батарей, которые являются источником питания для мобильных устройств, электромобилей и портативных электронных устройств. Кроме того, литий используется в производстве алюминиевых сплавов, стекла, лекарственных препаратов и смазочных материалов.
2. Натрий: Натрий находит широкое применение в пищевой промышленности, где используется как консервант и регулятор кислотности. Он также используется в производстве стекла, моющих средств, бытовых электроприборов и ламп.
3. Калий: Калий является важным элементом для растений и используется в сельском хозяйстве как удобрение. Он также используется в производстве стекла, мыла, диетических добавок и лекарственных препаратов.
4. Рубидий и цезий: Рубидий и цезий имеют низкую различимость в промышленности, однако они широко используются в научных исследованиях и разработке новых технологий. Например, цезий используется в атомных часах, спутниковой навигации и медицинских процедурах, таких как радиотерапия и томография.
Таким образом, щелочные металлы находят применение в различных сферах жизни, обеспечивая энергией, улучшая качество продукции и способствуя развитию научных исследований и технологий.
Вопрос-ответ

Почему щелочные металлы являются легко окисляемыми на воздухе?
Щелочные металлы (например, литий, натрий, калий) реагируют с влагой в воздухе и образуют гидроксиды. Гидроксиды этих металлов являются щелочными растворами, которые легко окисляются кислородом воздуха.
Какие примеры реакций легкой окисляемости щелочных металлов на воздухе?
Примером реакции легкой окисляемости щелочных металлов на воздухе может быть реакция калия с кислородом. В результате этой реакции образуется оксид калия (K2O), который является веществом с выраженными щелочными свойствами.
Какая роль играет влага в реакциях щелочных металлов на воздухе?
Влага играет важную роль в реакциях щелочных металлов на воздухе. Она реагирует с металлами, образуя гидроксиды, которые затем могут окисляться кислородом воздуха.
Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются низкой плотностью, мягкостью и низкой электроотрицательностью.
