Азот - химический элемент, который обладает уникальными свойствами и является одним из основных компонентов атмосферы Земли. Ранее азот относили к неметаллам, однако в последнее время возникает вопрос о его классификации. Некоторые исследователи предполагают, что азот имеет как металлические, так и неметаллические свойства. Давайте рассмотрим основные аргументы обеих точек зрения.
Свойства металлов включают высокую электропроводность, блеск, пластичность и теплопроводность. Азот не обладает этими свойствами, поэтому его можно отнести к неметаллам. Однако существуют и аргументы в пользу того, что азот может иметь металлические свойства.
Некоторые исследования показывают, что азот при высоком давлении и низкой температуре может принять металлическую кристаллическую структуру. Это свидетельствует о возможной металлической природе азота. Кроме того, некоторые химические свойства азота могут напоминать металлы, например, его способность образовывать ионы с положительным зарядом.
Возможно, классификация азота как металла или неметалла требует дальнейших исследований и обсуждений. Пока что научное сообщество не пришло к единому мнению по этому вопросу.
Независимо от конечного решения о классификации азота, его значимость для живых организмов и промышленности неоспорима. Азот является необходимым элементом для роста растений и составляет основу белков, гормонов и ДНК. Он также используется в производстве товаров, таких как удобрения и взрывчатые вещества. Поэтому изучение свойств азота имеет большое практическое значение для различных областей науки и промышленности.
Химический элемент с символом N

Азот (N) - химический элемент 7-й группы периодической таблицы Менделеева. Он относится к неметаллам и обладает символом N на латинском языке. Азот является одним из важнейших элементов, необходимых для жизни на Земле.
Азот встречается в природе преимущественно в атмосфере, где составляет около 78% общего объема. Он также присутствует в органических соединениях, таких как белки, аминокислоты и нуклеиновые кислоты. Азот является неотъемлемой частью всех живых организмов.
Характеристикой азота является его стабильность. Он не горит и не поддерживает горение, что делает его безопасным элементом. Более того, азот является инертным газом при нормальных условиях и обладает высоким температурным стабильным диапазоном.
Из азота производят значительное количество химических соединений, таких как аммиак, нитраты и нитриты. Азот также играет важную роль в промышленности, используется для синтеза удобрений и в производстве пластмасс, взрывчатых веществ и красителей.
В целом, азот является неотъемлемым элементом для нашей планеты и жизни в целом. Его уникальные свойства делают его незаменимым во многих отраслях науки, промышленности и сельском хозяйстве.
Позиция в Периодической системе

Азот (N) представляет собой химический элемент, который находится в периодической системе во второй группе главной подгруппы, с группой 15 и периодом 2. Он относится к неметаллам, что подтверждает его сравнительно низкую электропроводность и неметаллическое химическое поведение.
Азот находится после бора (B) и алюминия (Al) и перед кислородом (O) и фтором (F) в периодической системе. Это элемент, чья атомная масса примерно равна 14. Позиция азота в периодической системе отражает его свойства и химическую активность.
Также стоит отметить, что в таблице Менделеева азот находится между элементами металла бора и неметалла кислорода. Кроме того, в периодической системе азот находится во втором периоде, который является периодом для элементов с электронной конфигурацией 1s^2 2s^2 2p^3.
Физические свойства и состояние

Азот - химический элемент из группы воздуха, который обычно находится в газообразном состоянии. При нормальных условиях (температуре и давлении) азот является безцветным и беспрозрачным газом. Однако при очень низких температурах азот может переходить в жидкое или даже твердое состояние.
Одной из особенностей азота является его невозгораемость - газ не горит и не поддерживает горение. Благодаря этому свойству азот широко применяется в промышленности и в научных исследованиях, например, в емкостях для хранения и транспортировки горючих веществ.
Также азот обладает интересным физическим свойством - он охлаждает предметы при контакте с ними. Это связано с его способностью быстро испаряться и забирать тепло из окружающей среды. Благодаря этому свойству азот используется в медицине для высокоточного охлаждения, например, при удалении бородавок или раневом покрытии.
Из-за низкой текучести азота он используется также в промышленности для замораживания и хранения пищевых продуктов. Это позволяет сохранить их свежесть и качество на более длительный срок.
Таким образом, физические свойства азота, такие как невозгораемость, способность к охлаждению и низкая текучесть, делают его важным и универсальным веществом в различных областях науки и промышленности.
Химические свойства азота

1. Реакции азота с металлами: азот обладает способностью образовывать различные нитриды (соединения азота с металлами). Например, реакция азота с натрием приводит к образованию натриевого нитрида (Na3N).
2. Реакции азота с неметаллами: азот может реагировать с неметаллами в зависимости от условий. Например, при высоких температурах азот может реагировать с кислородом, образуя оксид азота (NO) или двуокись азота (NO2).
3. Образование азотистых соединений: азот может образовывать соединения с различными элементами, включая водород, углерод, кислород и другие. Например, аммиак (NH3) является одним из наиболее известных азотистых соединений.
4. Каталитическая активность азота: азот обладает каталитической активностью и может участвовать в различных химических реакциях. Например, азот может служить катализатором при синтезе аммиака по Хаберу.
5. Реакции азота с кислотами: азот может реагировать с различными кислотами, образуя азотную кислоту (HNO3) или ее производные. Например, азот может реагировать с серной кислотой, образуя азотистую кислоту (HNO2).
Таким образом, азот – химически активный элемент, обладающий свойствами как металла, так и неметалла. Его способность к образованию различных соединений позволяет ему играть важную роль в биологических и промышленных процессах.
Роль азота в живых организмах
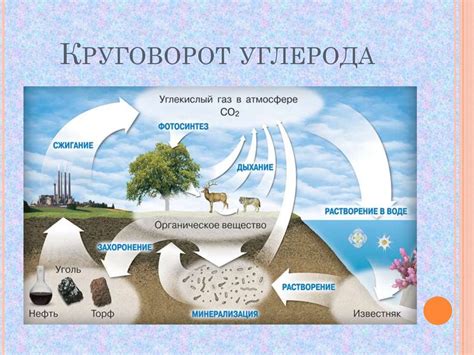
Азот является неотъемлемым элементом живых организмов, играющим важную роль в их жизнедеятельности. Азот входит в состав белков, нуклеиновых кислот, витаминов, аминокислот и других органических соединений.
Белки являются основной структурной единицей клеток и организмов. В их состав входят различные аминокислоты, включая азотсодержащие. Азотные основания, такие как аденин, гуанин, цитозин, тимин и урацил, обеспечивают синтез нуклеиновых кислот – ДНК и РНК.
Азот также необходим для образования аминокислот, молекулы, которые являются важными метаболитами и строительными блоками клеток и тканей организма. Благодаря аминокислотам в организме синтезируются ферменты, гормоны и другие биологически активные вещества.
Азот выступает также важным компонентом растительного питания. Растения поглощают нитраты и аммиак из почвы, а затем используют их для синтеза белков и других органических молекул. Животные, в свою очередь, получают азот с пищей, употребляя растительные и животные продукты.
Таким образом, азот играет ключевую роль в живых организмах, участвуя в синтезе белков, нуклеиновых кислот, аминокислот и других важных органических соединений. Его циклизация и использование в организмах находятся взаимосвязи с другими биохимическими процессами и обеспечивают нормальное функционирование клеток и тканей.
Применение азота в промышленности

Азот является одним из самых важных элементов в промышленности и имеет широкий спектр применений. Во-первых, он используется в процессе производства азотной кислоты, которая является основным сырьем для получения различных удобрений и взрывчатых веществ.
Кроме того, азот применяется в процессе синтеза аммиака, который служит исходным материалом для производства различных химических соединений, в том числе пластмасс, удобрений и лекарственных препаратов. Азот также используется в жидком состоянии в качестве охлаждающего агента при изготовлении электроники и при эксплуатации ядерных реакторов.
Для пищевой промышленности азот имеет большое значение при упаковке и хранении продуктов. Заполняя среду азотом, можно значительно продлить срок годности пищевых товаров, так как азот является инертным газом и не проявляет реакции с пищевыми продуктами.
Кроме того, азот используется и в других областях промышленности, таких как производство стали, производство сжатого воздуха, изготовление стекла, производство керамических изделий и многих других технических процессах.
Вопрос-ответ

К какой группе химических элементов относится азот?
Азот относится к химической группе элементов, известной как неметаллы.
Какие свойства азота указывают на его неметаллическую природу?
Азот обладает такими характеристиками, как недостаток проводимости электрического тока, отсутствие металлического блеска и формирование ковалентных соединений.
Могут ли некоторые свойства азота заставить сомневаться в его классификации как неметалла?
На самом деле, некоторые свойства азота, такие как его высокая плотность и температура плавления, могут вызывать сомнения в его классификации как неметалла. Однако, исходя из его химической активности и образования ковалентных связей, он все же является неметаллом.
Какие элементы являются металлами по сравнению с азотом?
Элементы, такие как железо, алюминий и медь, являются металлами по сравнению с азотом.
