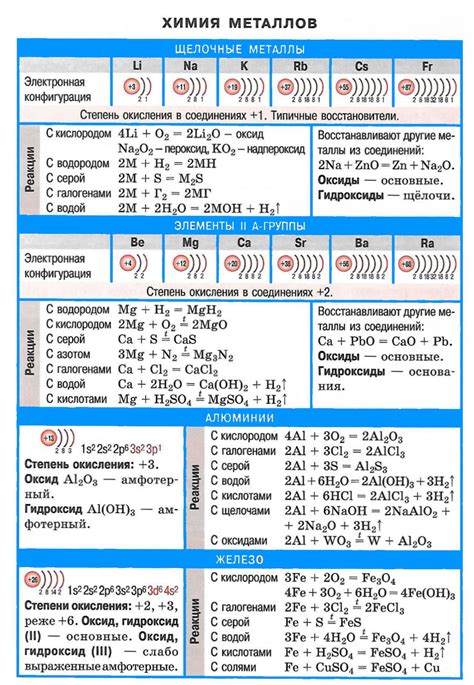
Щелочные металлы, такие как литий, натрий и калий, являются реактивными элементами. Их взаимодействие с кислородом воздуха происходит с высокой интенсивностью и сопровождается образованием ярких пламенных реакций. Данная особенность связана с тем, что щелочные металлы характеризуются высокой активностью и электроотрицательностью, что позволяет им образовывать стабильные соединения с кислородом.
Простота взаимодействия щелочных металлов с кислородом воздуха обусловлена их низкой ионизационной энергией и невысокой энергией связи между атомами. Поэтому при контакте с кислородом, он может легко проникать во внутренние слои атомов щелочных металлов и происходит образование ионов металла с положительным зарядом.
Стоит отметить, что реакция щелочных металлов с кислородом воздуха сопровождается выделением большого количества тепла. Иначе говоря, она является экзотермической, что означает, что в процессе образуются высокоэнергетические соединения.
Кроме этого, взаимодействие щелочных металлов с кислородом воздуха приводит к образованию щелочных оксидов и гидроксидов. Так, например, литий при взаимодействии с кислородом образует оксид Li2O, натрий - оксид Na2O, а калий - оксид KO2 и гидроксид KOH.
Учитывая высокую реакционную способность щелочных металлов с кислородом воздуха и огнестойкость образующихся соединений, необходимо соблюдать осторожность при работе с ними. Взаимодействие щелочных металлов с кислородом воздуха может быть использовано в различных процессах, включая производство энергии и химическую промышленность.
Щелочные металлы: определение и свойства
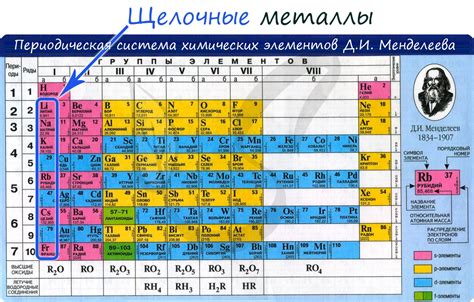
Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают определенными химическими свойствами, которые делают их уникальными и широко используемыми в различных областях.
Одним из основных свойств щелочных металлов является их высокая реактивность и способность легко взаимодействовать с другими веществами. Они легко реагируют с водой, освобождая водород и образуя гидроксиды. Это делает их хорошими реагентами в химических экспериментах и промышленности.
Щелочные металлы обладают также высокой электроотрицательностью, что делает их отличными электролитами в различных системах. Их соединения могут проводить электрический ток и используются в батареях, аккумуляторах и других устройствах, где требуется электрическая проводимость.
Еще одним важным свойством щелочных металлов является их низкая плотность. Они легче многих других металлов и могут плавать на поверхности жидкостей, таких как вода. Их низкая плотность делает их полезными для использования в авиации, космической промышленности и других областях, где важно снижение веса и увеличение эффективности.
Кроме того, щелочные металлы обладают высокой теплопроводностью и плавятся при низких температурах. Это делает их полезными в процессе пайки и сварки, а также в других технологических процессах, требующих высокой теплопроводности и плавления металлов.
- Литий (Li)
- Натрий (Na)
- Калий (K)
- Рубидий (Rb)
- Цезий (Cs)
- Франций (Fr)
Таблица щелочных металлов:
| Элемент | Символ | Атомная масса |
| Литий | Li | 6.941 |
| Натрий | Na | 22.990 |
| Калий | K | 39.098 |
| Рубидий | Rb | 85.468 |
| Цезий | Cs | 132.905 |
| Франций | Fr | 223.0 |
Вывод: щелочные металлы имеют ряд уникальных свойств, которые делают их важными и полезными в различных областях науки и технологии. Их высокая реактивность, электроотрицательность, низкая плотность, высокая теплопроводность и низкая температура плавления делают их ценными материалами для многих процессов и применений.
Реактивность щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой реактивностью, что делает их важными элементами в химической индустрии. Эти металлы легко реагируют с кислородом воздуха, образуя оксиды. Эта реакция является экзотермической, то есть сопровождается выделением тепла.
Щелочные металлы имеют низкую ионизационную энергию, что делает их атомы стабильными и легко отдающими электроны. При контакте с кислородом, металлы окисляются, а кислород восстанавливается. Этот процесс называется окислительным восстановлением.
В результате реакции щелочных металлов с кислородом воздуха образуются соответствующие оксиды. Например, литий при взаимодействии с кислородом образует оксид лития, который имеет формулу Li2O. Оксиды щелочных металлов обладают особыми свойствами, которые находят применение в различных отраслях промышленности.
Интересно отметить, что реактивность щелочных металлов с кислородом воздуха зависит от их положения в периодической таблице. Натрий, расположенный ниже лития, более активен в реакции с кислородом и образует более стабильный оксид. Калий, находящийся ниже натрия, еще более реактивен и образует оксид калия.
Взаимодействие щелочных металлов с кислородом

Взаимодействие щелочных металлов с кислородом является фундаментальным процессом, имеющим существенное значение в химии и технологии. Кислород, будучи одним из основных химических элементов, является активным агентом во многих химических реакциях, включая окисление веществ. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются наиболее группой реакционноспособных металлов и проявляют различные свойства при взаимодействии с кислородом.
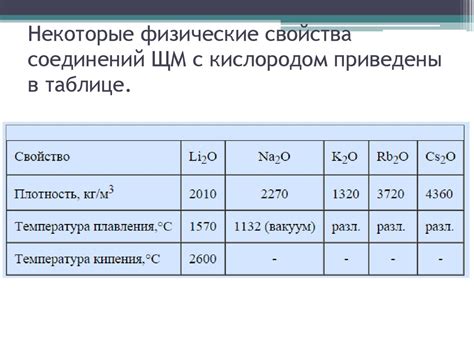
При контакте щелочных металлов с кислородом происходит образование оксидов, которые могут иметь различные степени окисления металла. Например, литий образует оксид Li2O, натрий - оксид Na2O, калий - оксид K2O, рубидий - оксид Rb2O и цезий - оксид Cs2O. Эти оксиды обладают щелочными свойствами и растворяются в воде, образуя гидроксиды металлов.
Взаимодействие щелочных металлов с кислородом также может приводить к образованию пероксидов, в которых кислород имеет степень окисления -1. Например, литий образует пероксид Li2O2, натрий - пероксид Na2O2 и калий - пероксид K2O2. Эти вещества обладают окислительными свойствами и могут быть использованы в различных процессах.
Таким образом, взаимодействие щелочных металлов с кислородом является сложным и разнообразным процессом, который имеет множество применений в химии и технологии. Изучение этого взаимодействия позволяет расширить наши знания о свойствах и реакционной способности щелочных металлов, а также применить их в различных сферах науки и промышленности.
Окисление и подвергание щелочных металлов реакции
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, вступают в реакцию с кислородом воздуха, что приводит к их окислению. Когда щелочный металл подвергается взаимодействию с кислородом, происходит образование оксидов металлов. Например, литий реагирует с кислородом, образуя оксид лития (Li2O), а натрий - оксид натрия (Na2O).
В результате реакции с кислородом щелочные металлы проявляют свою высокую химическую реактивность и способность быстро окисляться. Оксиды щелочных металлов обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы.
Окисление щелочных металлов под воздействием кислорода происходит с выделением большого количества тепла и образованием искр, что является характерным признаком данной реакции. Этот процесс называется горением металла.
К такой реакции способны все щелочные металлы, однако их скорость и интенсивность различны. Например, литий горит с ярким пламенем, а калий может даже взрываться при контакте с кислородом воздуха.
Таким образом, окисление и подвергание щелочных металлов реакции с кислородом воздуха является важным и уникальным явлением, которое обусловлено особенностями химических свойств этих металлов.
Формирование оксидов щелочных металлов

Щелочные металлы (литий, натрий, калий и др.) обладают высокой активностью и легко взаимодействуют с кислородом воздуха, образуя оксиды. Формирование оксидов является процессом, при котором щелочные металлы окисляются и образуют соединения с кислородом.
Взаимодействие щелочных металлов с кислородом протекает в результате реакции окисления, при которой металл отдает электроны кислороду. Реакция происходит очень быстро и сопровождается выделением тепла.
- Литий при взаимодействии с кислородом образует окись лития (Li2O), которая обладает ионным строением. Окись лития является белым кристаллическим веществом и используется в производстве литиевых батарей.
- Натрий образует оксид натрия (Na2O), который является белым кристаллическим соединением. Оксид натрия широко применяется в стекольной промышленности и при производстве мыла.
- Калий образует оксид калия (K2O). Оксид калия является белым кристаллическим веществом, используется в производстве удобрений и стекла.
Формирование оксидов щелочных металлов является важным процессом, который находит применение в различных отраслях промышленности и технологии. Классическим примером взаимодействия щелочных металлов с кислородом является горение щелочных металлов в воздухе.
Химическое взаимодействие между щелочными металлами и кислородом воздуха

Химическое взаимодействие между щелочными металлами и кислородом воздуха является одним из самых изученных в химии. Это процесс, который приводит к образованию оксидов щелочных металлов.
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются очень реакционными и легко образуют соединения с кислородом. При контакте с воздухом, поверхность щелочных металлов покрывается тонкой пленкой оксида, которая защищает металл от дальнейшего окисления.
Процесс окисления щелочных металлов является экзотермическим, то есть сопровождается выделением тепла. Это объясняет их горение в воздухе или реакцию с водой, зачастую с проникновением огня и высокой энергией.
Окислительные свойства щелочных металлов проявляются во многих реакциях, особенно в сочетании с более высокоокислительными веществами. Они способны образовывать сольные соединения, такие как пероксиды, супероксиды и пероксоксиды, которые широко используются в промышленности и медицине.
Химическое взаимодействие между щелочными металлами и кислородом воздуха является одной из основ процессов, определяющих свойства щелочных металлов. Изучение этих реакций позволяет оптимизировать их использование и применение в различных областях науки и техники.
Применение результатов взаимодействия щелочных металлов с кислородом воздуха

Исследования взаимодействия щелочных металлов с кислородом воздуха имеют широкий спектр применений, как в научных исследованиях, так и в практических областях. Результаты этих исследований могут быть использованы для разработки новых материалов, катализаторов и электродов.
Одним из основных направлений применения результатов исследований является область энергетики. Щелочные металлы, взаимодействуя с кислородом воздуха, могут быть использованы в процессе производства энергии, например, в батареях с металл-воздушным элементом. Такие батареи могут иметь высокую энергоемкость и быть экологически чистыми.
Кроме того, результаты исследования взаимодействия щелочных металлов с кислородом воздуха могут найти применение в химической промышленности. Кислородные соединения, образующиеся в результате реакции, могут служить сырьем для получения различных химических продуктов, таких как оксиды, гидроксиды и пероксиды щелочных металлов.
Еще одной областью применения результатов исследований является медицина. Щелочные металлы могут быть использованы для разработки новых лекарственных препаратов и катализаторов для реакций, связанных с дыханием организма, таких как окислительное фосфорилирование. Это может привести к созданию более эффективных и безопасных методов лечения.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Чем отличается взаимодействие щелочных металлов с кислородом воздуха?
Взаимодействие щелочных металлов с кислородом воздуха происходит с образованием оксидов. Литий образует оксид Li2O, натрий - Na2O, калий - KO2, рубидий - RbO2, цезий - CsO2.
Какие особенности характерны для взаимодействия щелочных металлов с кислородом воздуха?
Одной из особенностей взаимодействия щелочных металлов с кислородом воздуха является быстрота реакции окисления металлов при комнатной температуре. Также некоторые щелочные металлы образуют супероксиды (например, KO2, RbO2, CsO2), которые дальше разлагаются на пероксиды и кислород.
Какие свойства оксидов щелочных металлов?
Оксиды щелочных металлов являются щелочными соединениями. Они обладают высокой щелочностью и растворяются в воде, образуя щелочные растворы. Многие из них также образуют гидроксиды при реакции с водой.
