Металлические кристаллы – это тип структуры, которая образуется при взаимодействии металлических элементов. В отличие от других типов кристаллических структур, таких как ионные или ковалентные, связи в металлических кристаллах являются металлическими. Эта особая форма химической связи определяет множество уникальных свойств металлических материалов.
Металлическая связь характеризуется наличием свободных электронов, которые могут свободно передвигаться между атомами в структуре. Эти свободные электроны формируют электронное облако, окружающее положительно заряженные ядра металлических атомов. Благодаря этому, металлические кристаллы обладают высокой электропроводностью и теплопроводностью, а также обладают механической прочностью и пластичностью.
Благодаря особенностям металлической связи, металлические кристаллы способны проводить электрический ток без потерь энергии. Свободные электроны способны легко перемещаться под влиянием электрического поля и передавать энергию по всей структуре металлического кристалла. Именно поэтому металлы широко используются в электротехнике и электронике.
Определение металлического кристалла
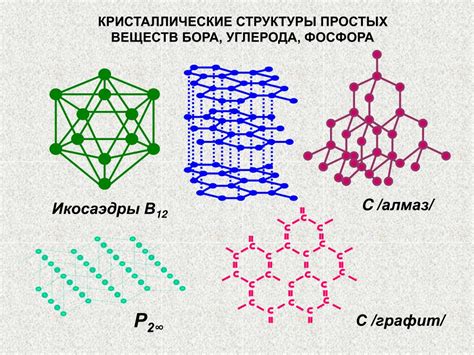
Металлический кристалл - это особый тип кристаллической структуры, который образуется при формировании твердого металла. В отличие от других типов кристаллов, металлический кристалл обладает несколькими характеристиками, которые определяют его свойства.
Один из ключевых признаков металлического кристалла - это наличие свободных электронов в его структуре. Эти электроны являются мобильными и могут свободно перемещаться по кристаллической решетке. Именно благодаря этому свойству металлы обладают хорошей электропроводностью.
Еще одним важным свойством металлического кристалла является его плотность упаковки. Атомы в металлах располагаются в кристаллической решетке очень плотно, что обусловливает их высокую плотность и твердость. Благодаря этому свойству металлы обладают высокой механической прочностью.
Также следует отметить, что свойства металлического кристалла обусловлены видом химической связи, который характеризуется наличием делящихся электронных облаков. Это обусловливает такие свойства металлов, как пластичность и способность к деформации без разрушения.
В целом, металлические кристаллы обладают уникальными физическими свойствами, которые обуславливают их широкое использование в различных отраслях промышленности и науки.
Химическая связь в металлах

Химическая связь в металлах является основой для понимания свойств металлических кристаллов. Она отличается от ионной и ковалентной связей, которые присущи другим типам веществ. В основе химической связи в металлах лежит так называемая "электронная область общего достояния", в которой электроны имеют возможность свободно перемещаться. Это делает металлы отличными проводниками электричества и тепла.
Металлическая связь образуется между позитивно заряженными ионами металлов и электронами, которые не принадлежат к какому-либо конкретному атому. В результате такой связи металлический кристалл обладает определенными свойствами, такими как пластичность, жесткость и хорошая проводимость электричества и тепла.
Одним из важных свойств метальных кристаллов является их способность образовывать легколетучие сплавы. Это объясняется тем, что электроны, находящиеся в "электронной области общего достояния", легко переходят между атомами разных металлов, что позволяет создавать сплавы с различными химическими и физическими свойствами.
Химическая связь в металлах также обуславливает возможность образования кристаллической решетки, в которой атомы металлов регулярно упорядочены. Это позволяет металлам обладать определенной кристаллической структурой и способностью образовывать границы зерен, что влияет на их механические свойства, например прочность и твердость.
Таким образом, химическая связь в металлах играет ключевую роль в определении их химических, физических и механических свойств. Она обеспечивает особую структуру и электронные свойства металлических материалов, что делает их одними из наиболее важных и широко используемых материалов в современной технологии и промышленности.
Электронная структура металлических кристаллов
Электронная структура металлических кристаллов играет важную роль в определении их свойств. Металлы характеризуются высокой электропроводностью, пластичностью и теплопроводностью, которые объясняются особенностями их электронной структуры.
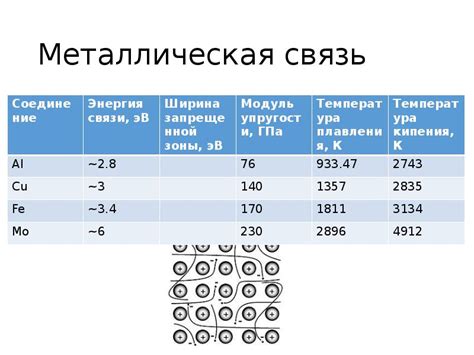
В металлических кристаллах атомы соединены между собой металлической связью, которая характеризуется свободными электронами в проводимой зоне. Внутри кристалла электроны образуют электронное облако, которое является своего рода "морем" электронов. Это облако предоставляет неподвижным атомам возможность свободно передвигаться, что обуславливает свойства металлов.
Металлические связи свойственны многим металлам, например, железу, алюминию, меди и золоту. Они обладают металлической структурой, в которой каждый атом единичной ячейки окружен шестью соседними атомами. Эмпирическая формула, подобная Cu, Ag или Fe, демонстрирует наличие твердых кристаллических положений металлов.
Казалось бы, свободные электроны могут сконцентрироваться в одной части структуры металлического кристалла. Тем не менее, металлы имеют общие характеристики, связанные с подвижностью свободных электронов. Это позволяет объяснить многие их свойства, такие как электропроводность и теплоемкость.
Проводимость металлических кристаллов
Металлические кристаллы обладают высокой проводимостью электрического тока, что делает их уникальными материалами для различных промышленных и научных приложений.
Проводимость металлов обусловлена специфическим типом химической связи, называемой металлической связью. В отличие от ионной или ковалентной связи, металлическая связь возникает между атомами металла и образует общую электронную оболочку, называемую электронным газом. Эти свободные электроны могут свободно передвигаться по кристаллической решетке металла, что обеспечивает эффективное провожение электрического тока.
Кроме того, проводимость металлических кристаллов зависит от других факторов, таких как концентрация свободных электронов, масса и заряд ионов в кристаллической решетке. Металлы с большим числом свободных электронов обычно обладают лучшей проводимостью. Также влияние оказывают дефекты решетки, такие как примеси или дислокации, которые могут уменьшить или увеличить проводимость металла.
Проводимость металлических кристаллов может быть изменена при воздействии внешних факторов, таких как температура или внешнее электрическое поле. Например, при понижении температуры проводимость металла может существенно возрастать, что объясняется снижением влияния колебаний атомов на движение свободных электронов. Это явление известно как эффект блокировки. Также при наличии внешнего электрического поля проводимость металла может изменяться в зависимости от его направления и интенсивности.
Механические свойства металлических кристаллов
Металлы - это вещества, имеющие высокую проводимость электричества и тепла, обладающие пластичностью и способностью образовывать кристаллическую решетку. И именно кристаллическая структура металлических материалов определяет их механические свойства.
Прочность - одно из основных механических свойств металлических кристаллов. Прочность зависит от вида химической связи в металлической решетке. Межатомные взаимодействия в металлах обеспечивают высокую прочность, поэтому металлы отличаются высокой устойчивостью к механическим воздействиям.
Твердость - это свойство материала сопротивляться проникновению других твердых тел. В металлических кристаллах твердость зависит от ориентации и взаимного положения атомов в кристаллической решетке. Она может быть увеличена добавлением сплавных элементов, изменением структуры кристаллической решетки или проведением термической обработки.
Пластичность - способность материала деформироваться без разрушения при воздействии внешних нагрузок. Металлические кристаллы обладают высокой пластичностью благодаря наличию пустых слоев в кристаллической решетке, которые могут перемещаться и обеспечивать пластическую деформацию. Это позволяет металлам быть легко формованными и использоваться в различных отраслях промышленности.
Упругость - свойство материала возвращать свою форму и размеры после удаления деформирующей силы. Металлические кристаллы обладают высокой упругостью благодаря малым межатомным расстояниям и наличию обобщенных атомных упругих перемещений в кристаллической решетке.
Таким образом, механические свойства металлических кристаллов определяются их кристаллической структурой и видом химической связи, что делает металлы ценными материалами в промышленности и строительстве.
Температурные свойства металлических кристаллов
Металлические кристаллы обладают рядом уникальных температурных свойств, которые связаны с особенностями их химической связи. Одной из наиболее известных характеристик металлов является их высокая теплопроводность. Благодаря свободному перемещению электронов в кристаллической решетке металлы способны передавать тепло очень эффективно. Это свойство делает металлы отличными материалами для использования в технике и промышленности.
Важным температурным свойством металлических кристаллов является их способность проводить электрический ток. Благодаря наличию свободных электронов, металлы обладают высокой электрической проводимостью. При повышении температуры в металле возрастает искрая амплитуда колебаний атомов в кристаллической решетке, что увеличивает вероятность столкновений электронов и затрудняет электронную проводимость. Однако, при очень низких температурах свойства металлов могут меняться и проявлять особые эффекты, такие как сверхпроводимость.
Важное температурное свойство металлических кристаллов связано с их плавкостью. Плавкость металлов зависит от энергии связи между атомами в кристаллической решетке. При достижении определенной температуры энергия атомов становится настолько высокой, что химическая связь между ними слабеет и металл начинает плавиться. Температура плавления металлов может варьироваться от очень низких значений, как у ртути (-38,87 °C), до очень высоких, как у вольфрама (3422 °C).
В целом, температурные свойства металлических кристаллов определяются их химической структурой и взаимодействием атомов в кристаллической решетке. Благодаря этим свойствам металлы находят широкое применение в различных сферах, начиная от электроники и машиностроения и заканчивая энергетикой и металлургией.
Влияние химической связи на свойства металлических кристаллов
Свойства металлических кристаллов обусловлены видом химической связи, которая присутствует между атомами внутри кристаллической решетки материала. Химическая связь в металлических кристаллах является металлической, когда электроны внешней оболочки атомов свободно перемещаются по всей структуре кристалла.
Одно из основных свойств металлических кристаллов, обусловленных металлической связью, - высокая электропроводность. Из-за свободного перемещения электронов, металлы обладают способностью проводить электрический ток. Эта свойство делает металлы полезными для производства проводников электричества и других электронных устройств.
Кроме того, металлическая связь в металлических кристаллах придает им хорошую термическую и электрическую проводимость. Это объясняется тем, что свободные электроны могут эффективно передавать как электрическую, так и тепловую энергию между атомами.
Еще одним важным свойством металлических кристаллов, обусловленным химической связью, является их ковкость и пластичность. Металлическая связь позволяет атомам в кристаллической структуре сдвигаться друг относительно друга без нарушения связей. Это делает металлы гибкими и пластичными, что является основой для формовки и легкой обработки металлических изделий.
Таким образом, вид химической связи, присутствующей в металлических кристаллах, существенно влияет на их свойства. Металлическая связь придает металлам высокую электропроводность, термическую и электрическую проводимость, а также ковкость и пластичность.
Вопрос-ответ

Как вид химической связи влияет на свойства металлических кристаллов?
Вид химической связи в металлических кристаллах определяет множество свойств, включая электропроводность, теплопроводность и пластичность. Это связано с тем, что металлическая связь обеспечивает свободное движение электронов в кристаллической решетке, что обеспечивает быстрое и эффективное распространение энергии и зарядов.
Какую роль играют электроны в металлических кристаллах?
Электроны в металлических кристаллах являются основными участниками в процессе связывания атомов. Они образуют так называемую "море электронов", которое окружает положительно заряженные ионы металла. Электроны могут свободно двигаться по кристаллической решетке, обеспечивая хорошую проводимость и другие свойства, характерные для металлов.
Чем отличается металлическая связь от других видов химической связи?
Металлическая связь отличается от других видов химической связи, таких как ионная или ковалентная, тем, что она не обязует электроны между конкретными атомами, а позволяет им свободно двигаться по всей кристаллической решетке. Это делает металлическую связь очень подвижной и эффективной для передачи энергии и зарядов.
