Щелочные металлы - это группа химических элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к одной из самых важных групп элементов, так как имеют ряд уникальных химических свойств, изучение которых широко распространено в рамках ЕГЭ.
Реакция с водой. Щелочные металлы реагируют с водой, образуящейся в процессе гидроксиды и выделяясь водород. При этом, активность реакции возрастает от лития к цезию. Также, при реакции с водой может наблюдаться выделение вспышки и возгорание металла при контакте с воздухом.
Реакция с кислотами. Щелочные металлы активно реагируют с кислотами, образуясь соли и выделяя водород. При этом, эта реакция также проявляет увеличение активности от лития к цезию.
Интересно отметить, что химические свойства щелочных металлов играют важную роль в подготовке к ЕГЭ по химии, так как задания на эту тему часто встречаются в экзаменационных билетах. Знание реакций щелочных металлов с водой и кислотами позволяет учащимся успешно выполнить соответствующие задания, а также самостоятельно проанализировать их результаты.
В дополнении к перечисленным свойствам, щелочные металлы являются отличными алкалино-земляными металлами, соответственно, обладают высокой электропроводностью, низкой температурой плавления и плотностью. Они широко используются в различных отраслях науки и техники, а также в производстве.
Таким образом, знание химических свойств щелочных металлов является важным в контексте подготовки к ЕГЭ по химии и обладает большим практическим значением, так как позволяет учащимся успешно справиться с заданиями и лучше понять работу этих элементов в химических реакциях и промышленности.
Щелочные металлы: определение, свойства

Щелочные металлы - это первая группа элементов периодической системы, к которой относятся литий, натрий, калий, рубидий, цезий и франций. Они получили название "щелочные" из-за своей способности образовывать щелочные растворы при взаимодействии с водой.
У щелочных металлов есть несколько характеристических свойств. Во-первых, они обладают низкой плотностью и мягкостью. Например, литий является легчайшим металлом и может быть разрезан ножом. Во-вторых, щелочные металлы хорошо проводят тепло и электричество. Они также обладают низкой температурой плавления, что делает их полезными материалами для создания сплавов и покрытий.
Одним из важных свойств щелочных металлов является их реактивность. Они очень активны химически и легко взаимодействуют с водой, кислородом и другими химическими веществами. Когда они реагируют с водой, образуются основания - щелочные растворы.
Щелочные металлы также образуют множество соединений с другими элементами. Например, они образуют соли, карбиды, гидриды и оксиды. Многие из этих соединений имеют практическое применение в промышленности и науке.
Таким образом, щелочные металлы обладают определенными химическими свойствами, которые делают их полезными в различных областях науки и технологии. Их реактивность и способность образовывать щелочные растворы являются основными особенностями, которые определяют их поведение и применение.
Определение и химический состав щелочных металлов
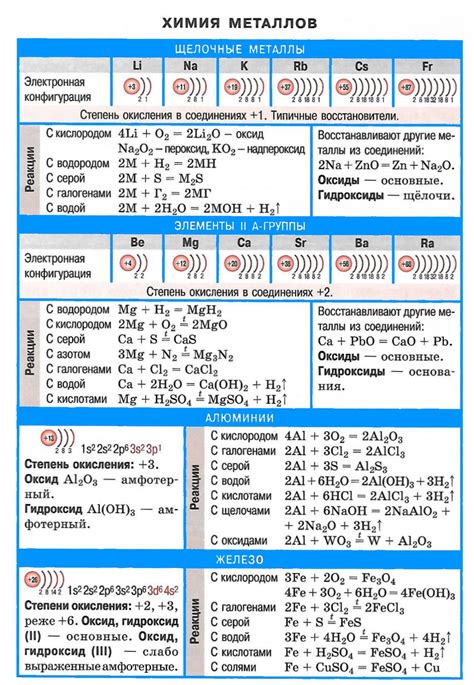
Щелочные металлы – это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили свое название из-за своей химической активности и свойств, схожих с щелочами. Щелочные металлы относятся к самым реактивным элементам, что делает их подходящими для множества химических реакций и применений.
Химический состав щелочных металлов обладает определенными особенностями. Они имеют одну валентность и легко отдают свой внешний электрон, образуя положительный ион. Щелочные металлы мягкие и их плотность невысока. Они обладают низкой температурой плавления и кипения.
Щелочные металлы активно реагируют с водой, образуя щелочные растворы, которые являются базами. При этом выделяется водород. В результате реакции щелочные металлы вступают в реакцию с кислородом, образуя оксид щелочного металла. Они также образуют соль с кислотами. Щелочные металлы обладают цветом пламени при горении, что позволяет установить их присутствие в веществе.
Таким образом, щелочные металлы – это группа элементов с химическим составом, обладающим уникальными свойствами, которые предопределяют их активность и множество возможных реакций. Их химический состав и свойства позволяют использовать их в различных областях науки и промышленности.
Физические и химические свойства щелочных металлов
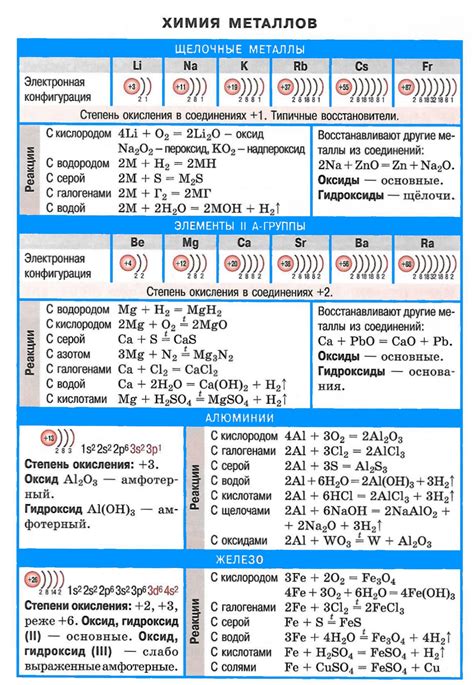
Щелочные металлы - это элементы, принадлежащие к первой группе (IA) периодической системы химических элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом особых физических и химических свойств, которые делают их важными в различных отраслях науки и промышленности.
Одной из особенностей щелочных металлов является их низкая плотность. Они имеют мягкую и пластичную структуру, и могут быть легко нарезаны ножом. Кроме того, они обладают низкой температурой плавления, что делает их идеальными для использования в различных сферах, включая производство сплавов и аккумуляторов.
Щелочные металлы хорошо растворяются в воде, образуя щелочные растворы. При этом они выделяются многочисленные пузырьки газа и прогреваются. Это происходит из-за их высокой реактивности и готовности отдать электрон при взаимодействии с водой. Реакция с водой протекает очень интенсивно, и знание данной свойства имеет практическое значение при использовании щелочных металлов в промышленности.
Еще одним важным свойством щелочных металлов является склонность образовывать ионы с положительным зарядом. Они имеют один внешний электрон, который легко отделяется, образуя ион с однозначным положительным зарядом. Это свойство делает их хорошими ионными и соединительными элементами, применяемыми в различных химических процессах.
Итак, физические и химические свойства щелочных металлов определяют их важное место в химической промышленности и научных исследованиях. Их низкая плотность, высокая реактивность и способность образовывать однозначно заряженные ионы делают эти элементы уникальными и широко используемыми в различных областях науки и технологий.
Реакции щелочных металлов с водой

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют ярко выраженные химические свойства при контакте с водой.
Реакция щелочного металла с водой протекает достаточно интенсивно. При взаимодействии металла с молекулами воды образуется щелочной оксид (гидроксид) и выделяется водород. Уравнение этой реакции можно представить следующим образом:
2M + 2H2O → 2MOH + H2
Газообразный водород, который образуется в результате этой реакции, может быть легко обнаружен и идентифицирован, так как он обладает высокой горючестью и горит с яркой желтой пламенем.
Протекание реакции щелочного металла с водой зависит от нескольких факторов, включая размер частиц металла, температуру воды и активность самого металла. Например, литий реагирует с водой очень интенсивно, образуя щелочной оксид и выделяясь водород. Натрий и калий также реагируют хорошо с водой, но рубидий и цезий реагируют значительно медленнее.
Восстановительные свойства щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, обладают высокой активностью в восстановительных реакциях. Это связано с их низкой ионизационной энергией, что позволяет им потерять электроны и образовать положительные ионы, которые легко отдают электроны другим веществам.
Одной из важных реакций, в которых проявляются восстановительные свойства щелочных металлов, является реакция с водой. Щелочные металлы реагируют с водой, высвобождая водород и образуя щелочь. Например, натрий реагирует с водой по следующему уравнению:
2Na + 2H2O → 2NaOH + H2
Эта реакция иллюстрирует способность щелочных металлов отдавать электроны, которые переходят на молекулы воды, вызывая ее распад и выделение газообразного водорода.
Кроме реакции с водой, щелочные металлы проявляют восстановительные свойства и в реакциях с кислородом. Например, литий реагирует с кислородом из воздуха, образуя оксид лития:
4Li + O2 → 2Li2O
Эта реакция показывает, что щелочные металлы способны отдавать электроны кислороду, что приводит к образованию ионов оксида.
Таким образом, восстановительные свойства щелочных металлов связаны с их способностью отдавать электроны в реакциях, в результате чего происходит изменение степени окисления элементов и образование ионов.
Щелочные металлы в ежегодных заданиях ЕГЭ по химии
Щелочные металлы - это первая группа периодической системы элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Их химические свойства широко представлены в заданиях ЕГЭ по химии. Щелочные металлы обладают сходными характеристиками, такими как мягкость, низкая плотность и низкая точка плавления.
Одной из особенностей щелочных металлов является их реакционная способность с водой. Литий, натрий и калий реагируют с водой с образованием гидроксидов и выделением водорода. Это свойство можно наблюдать в задачах ЕГЭ, где часто требуется рассчитать количество выделившегося водорода или полученное количество гидроксида.
В заданиях также часто встречаются реакции щелочных металлов с кислотами. При этом образуется соль и выделяется водород. Например, руководствуясь этими знаниями, можно решить задачу, в которой требуется найти массу получившейся соли при реакции данного металла с определенной кислотой.
Кроме того, щелочные металлы широко используются в заданиях, связанных с энергией источников электрического тока. Они являются активными металлами и хорошими проводниками электричества. Также задачи могут быть посвящены использованию щелочных металлов в высокотемпературных процессах, например, в производстве стекла или керамики.
Типичные варианты заданий по свойствам щелочных металлов

При решении заданий по свойствам щелочных металлов на ЕГЭ часто встречаются вопросы о их активности и реакционной способности. Будьте внимательны, необходимо учитывать, что активность щелочных металлов возрастает с увеличением номера элемента в периоде. Например, натрий более активен, чем литий, а калий - более активен, чем натрий. Это объясняется ростом атомного радиуса и уменьшением энергии ионизации.
Задания могут требовать сравнения активности щелочных металлов с другими элементами и сравнения активности элементов в разных условиях. Например, необходимо сравнить активность натрия и магния или сравнить активность лития в воде и в спирте. При ответе на такие вопросы следует учитывать электрохимический ряд металлов, где щелочные металлы располагаются вверху и являются самыми активными.
Задания могут предлагать описать реакцию щелочного металла с водой или реакцию с кислотой. Например, если щелочный металл реагирует с кислотой, то образуется соль и выделяется водород. Если металл реагирует с водой, то образуется гидроксид металла и выделяется водород. При ответе на такие задания важно помнить, что при реакции с водой образуются гидроксиды металлов, которые являются щелочными.
Также задания могут требовать описания реакций щелочных металлов с кислотами. Например, при реакции щелочного металла с кислотой образуется соль и вода. Чтобы правильно ответить на такое задание, нужно знать основные свойства щелочных металлов, включая их щелочность и условия их реакций с другими веществами.
Таким образом, для успешного решения заданий по свойствам щелочных металлов на ЕГЭ необходимо хорошо знать их основные химические свойства, такие как активность и реакционная способность. Также полезно знать электрохимический ряд металлов, чтобы сравнивать активность щелочных металлов с другими элементами. И, конечно, важно уметь применять эту теорию на практике и описывать реакции щелочных металлов с различными веществами.
Подготовка к задачам ЕГЭ с щелочными металлами

Для эффективной подготовки к задачам ЕГЭ, связанным с щелочными металлами, необходимо изучить их основные химические свойства. Во-первых, следует разобраться в реакции металлов с водой. Щелочные металлы активно реагируют с водой, образуя гидроксиды и высвобождая водород. Ударение следует делать на понимании соотношения между массами реагирующих веществ.
Важно учесть, что химические свойства щелочных металлов обусловлены их химической реакцией с кислородом. Так, при взаимодействии с кислородом воздуха щелочные металлы образуют оксиды, а в сочетании с неметаллами могут образовать соли. В задачах ЕГЭ можно столкнуться с вопросами о соотношении между массами реагирующих веществ, а также о балансировке химических уравнений. Рекомендуется тренироваться в решении таких задач, чтобы владеть навыками выполнения связанных с этим заданий.
Кроме того, для успешной подготовки к задачам ЕГЭ с щелочными металлами важно углубиться в тему растворимости гидроксидов щелочных металлов. Ученик должен понимать, что щелочные металлы образуют сильные щелочные растворы, которые могут взаимодействовать со многими кислотами. При этом, следует знать, что растворимость гидроксидов щелочных металлов увеличивается при повышении температуры. Это позволяет вывести различные задачи, связанные с расчетами концентрации растворов и их плотности.
Таким образом, предметная подготовка к задачам ЕГЭ с щелочными металлами должна базироваться на углубленном изучении их химических свойств, а также на тренировке выполнения типичных задач, связанных с массами реагирующих веществ, балансировкой химических уравнений и растворимостью гидроксидов. Важно ориентироваться на конкретные примеры и активно применять полученные знания при решении задач.
Вопрос-ответ

Какие вещества можно получить при реакции натрия с кислородом?
При реакции натрия с кислородом образуется оксид натрия (Na2O).
Что произойдет с образцом калия, если положить его в воду?
Калий реагирует с водой, образуя щелочной раствор, в котором образуется водород (H2) и водородоксид калия (KOН).
Какие металлы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Можно ли использовать калий в качестве консерванта?
Да, калий используется в качестве консерванта, так как он снижает активность воды и замедляет развитие микроорганизмов.
