Щелочные металлы – это элементы, которые относятся к первой группе периодической таблицы. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают уникальными химическими свойствами, которые определяют их широкое применение в различных областях науки и промышленности.
Одним из основных свойств щелочных металлов является их высокая реактивность. Они активно взаимодействуют с водой, кислородом, неметаллами и другими веществами. В результате химических реакций между щелочными металлами и кислородом образуются оксиды, а с водой – гидроксиды. Эти вещества имеют важное применение в производстве щелочей, гидроксидов и других химических соединений.
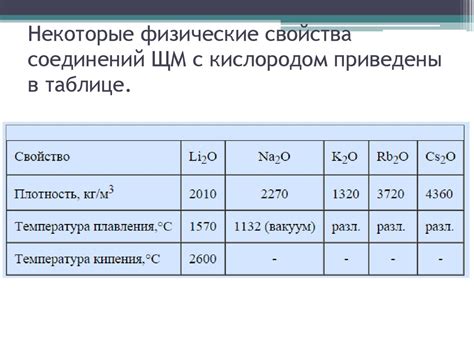
Щелочные металлы обладают высокой электроотрицательностью, что позволяет им легко образовывать положительные ионы в химических реакциях. Они обладают низкой температурой плавления и кипения, что делает их удобными материалами для использования в металлургии. Щелочные металлы также хорошо проводят электричество и тепло, поэтому их часто используют в производстве электроники и других технических устройств.
У щелочных металлов есть специфические свойства, которые определяют их растворимость в воде и их реакцию с кислотами. Они обладают высокой способностью образовывать ионы гидроксида в водном растворе, что делает их щелочными. Это свойство определяет их название – "щелочные" металлы. Они также образуют растворимые соли с кислотами, что может использоваться в лабораторных и промышленных процессах для нейтрализации кислых растворов.
Реактивность щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и другие, отличаются высокой реактивностью. Они являются самыми активными металлами в периодической системе. Взаимодействие щелочных металлов с другими веществами может быть очень интенсивным и вызывать различные химические реакции.
Например, щелочные металлы реагируют с водой, образуя щелочные растворы и выделяя водород. Реакция металла с водой протекает с выделением большого количества тепла и образованием гидроксида металла.
Они также реагируют с кислородом воздуха, образуя оксид металла. Некоторые щелочные металлы могут гореть при контакте с кислородом: например, литий с горением в воздухе образует белоснежный оксид.
Взаимодействие щелочных металлов с кислотами приводит к образованию соединений щелочно-металлических солей.
Реактивность щелочных металлов также проявляется в их способности образовывать сплавы с другими металлами, что позволяет использовать их в различных промышленных процессах и технологиях.
Роль щелочных металлов в органической химии

Щелочные металлы играют важную роль в органической химии благодаря своим уникальным свойствам и реакционной активности. Они обладают низкой электроотрицательностью и формируют наиболее устойчивые катионы, что обусловливает их способность образовывать ионы водорода и содействовать органическим реакциям с участием протонов.
В органической химии особую функциональность щелочные металлы проявляют в реакциях с карбонильными соединениями. Карбонильные соединения, такие как альдегиды и кетоны, образуют соли с щелочными металлами в результате присоединения катиона металла к карбонильной группе. Это может быть использовано при синтезе органических соединений.
Одной из важных реакций, в которых щелочные металлы играют ключевую роль, является реакция ацилирования. При ацилировании карбонильное соединение атакуется ацилирующим агентом в присутствии щелочного металла в виде его галогенида или оксида. Это приводит к образованию новой карбонильной группы в молекуле, что может быть использовано для создания новых органических соединений с необходимыми свойствами.
Также щелочные металлы играют важную роль в гидролизе эфиров, которая является одной из основных реакций органического синтеза. Гидролиз эфиров происходит в присутствии щелочного катализатора и приводит к образованию соответствующего спирта и карбоновой кислоты. Это позволяет эфиры использовать в качестве исходного материала для получения различных органических соединений.
В заключение, щелочные металлы играют значительную роль в органической химии, влияя на реакции с карбонильными соединениями, ацилирование и гидролиз эфиров. Их уникальные свойства и реакционная активность делают их важными инструментами для синтеза различных органических соединений и расширения возможностей органической химии.
Вопрос-ответ

Какие свойства щелочных металлов определяют их активность в химических реакциях?
Самое важное свойство щелочных металлов, определяющее их высокую активность в химических реакциях - это их большая химическая реакционная способность. Они активно реагируют с водой, кислородом, неметаллами, образуя щелочные оксиды, гидроксиды и соли. Кроме того, щелочные металлы обладают высокой электроотрицательностью, что позволяет им легко отдавать электроны и образовывать положительные ионы.
Какие свойства у щелочных металлов, делают их подходящими для использования в пиротехнике?
Щелочные металлы, такие как натрий, калий и литий, обладают свойствами, которые делают их прекрасными компонентами пиротехнических смесей. Например, они имеют низкую температуру плавления и могут быть легко активированы при помощи нагревания или воспламенения. Кроме того, щелочные металлы обладают способностью выделять яркие пламенные цвета, что делает их идеальными для создания разноцветных огней и фейерверков.
Какие щелочные металлы реагируют с водой, и что происходит в результате этой реакции?
Вода может реагировать с натрием, калием и литием - основными представителями щелочных металлов. В результате такой реакции образуется щелочная гидроксид и выделяется водород. Например, реакция натрия с водой выглядит следующим образом: 2Na + 2H₂О → 2NaOH + H₂.
Какие свойства щелочных металлов делают их опасными в обращении?
Щелочные металлы имеют несколько свойств, которые делают их опасными в обращении. Во-первых, они являются сильными окислителями, что может привести к возгоранию или даже взрыву при неправильном хранении или использовании. Во-вторых, они реагируют с влажным воздухом, образуя щелочные гидроксиды, которые могут вызывать ожоги при контакте с кожей или глазами. Наконец, щелочные металлы реагируют с водой, образуя взрывоопасный водород.
