Щелочные металлы являются первой группой элементов таблицы Менделеева и включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются от других элементов своей химической активностью и металлическими свойствами.
Щелочные металлы имеют низкую плотность, мягкие и легко обрабатываемые металлические свойства. Они обладают низкими температурами плавления и кипения, что делает их идеальными для использования в различных отраслях промышленности и научных исследованиях. Они также обладают высокой электроотрицательностью и могут реагировать с другими элементами, образуя очень активные соединения.
Среди основных свойств щелочных металлов следует отметить их способность образовывать ионы с положительным зарядом, что делает их мощными окислителями. Они также обладают низкими энергиями ионизации, что означает, что электроны в их внешней оболочке легко отрываются. Благодаря этому ѩелочные металлы хорошие проводники электричества и тепла. Кроме того, они образуют стабильные соединения с кислородом и обладают высокой реакционной способностью.
Таблица Менделеева
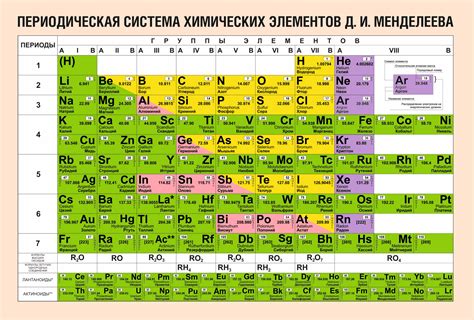
Таблица Менделеева является основой для организации и систематизации элементов химических веществ. Она состоит из горизонтальных строк - периодов, и вертикальных групп - групп и семейств элементов. Каждый элемент таблицы имеет свой порядковый номер, символ и атомную массу.
Таблица Менделеева позволяет наглядно представить химические свойства элементов, их электронную конфигурацию, а также отражает закономерности и тренды в периодической системе элементов. Например, в первой группе таблицы находится группа щелочных металлов.
Щелочные металлы - это элементы первой группы таблицы Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой реактивностью и являются мягкими металлами с низкой температурой плавления.
Основные свойства щелочных металлов включают высокую активность в реакциях с водой и кислородом, образование щелочных оксидов и гидроксидов, а также способность образовывать положительные ионы с однозначным зарядом.
Одной из особенностей щелочных металлов является их низкая плотность, что делает их легкими для использования в различных областях, таких как производство батареек, легирование сталей, производство электродов и многое другое.
Таблица Менделеева является основой для дальнейшего изучения и классификации элементов химических веществ, а также позволяет предсказывать их свойства и взаимодействия.
Свойства щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них есть несколько характерных свойств, которые отличают их от других элементов.
1. Активность: Щелочные металлы очень реактивны из-за своей низкой ионизационной энергии. Они легко отдают электроны и образуют положительные ионы. Это делает их отличными веществами для реакций с другими элементами и соединениями.
2. Мягкость: Щелочные металлы имеют низкую температуру плавления и относительно мягкие металлические свойства. Их мягкость связана с тем, что у них слабые валентные связи, так как атомы этих элементов имеют большой размер и малую электроотрицательность.
3. Высокая реактивность с водой: Щелочные металлы очень реактивны с водой. При контакте с водой они образуют гидроксиды и выделяются водород. Реакция щелочных металлов с водой может быть сильно экзотермической, что может привести к возгоранию воды.
4. Высокая электропроводность: Щелочные металлы являются хорошими проводниками электричества. Это связано с их способностью образовывать положительные ионы, которые легко перемещаются в кристаллической структуре металлов.
5. Химическая реактивность: Щелочные металлы обладают высокой химической реактивностью и относятся к самым реактивным элементам. Они реагируют с кислородом, водой, кислотами и другими веществами, что делает их полезными в промышленности и науке.
Химические свойства

- Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают сильными восстановительными свойствами. Они легко отдают свой электрон, образуя положительный ион, и реагируют с различными соединениями.
- Реакция с водой: Щелочные металлы реагируют с водой, образуя щелочь и выделяя водород. При этом происходит экзотермическая реакция, сопровождающаяся выделением тепла.
- Реакция с кислородом: Щелочные металлы активно реагируют с кислородом, образуя оксиды щелочных металлов. Эта реакция также является быстрой и сопровождается выделением тепла и света.
- Способность к образованию сплавов: Щелочные металлы обладают способностью образовывать сплавы с металлами и другими элементами. Эти сплавы обычно обладают хорошей пластичностью и низкой температурой плавления.
- Реакция с кислотами: Щелочные металлы реагируют с кислотами, образуя соли и выделяя водород. Эта реакция является экзотермической и сопровождается выделением тепла.
Физические свойства щелочных металлов

Щелочные металлы – это элементы периодической системы, относящиеся к I группе. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть ряд общих физических свойств, которые легко выделить при рассмотрении таблицы Менделеева.
- Низкая плотность: Щелочные металлы обладают низкой плотностью. Например, литий имеет плотность всего 0,53 г/см³, а калий – 0,86 г/см³.
- Низкая температура плавления: Щелочные металлы имеют низкую температуру плавления. Например, натрий плавится при 97,8 градусах Цельсия, а калий при 63,5 градусах.
- Мягкость: Щелочные металлы являются мягкими и легко деформируемыми. Наиболее мягкий из них – цезий, который можно резать ножом.
- Серебристый цвет: Щелочные металлы обладают серебристым цветом, характерным для металлов.
- Большая проводимость электричества и тепла: Щелочные металлы являются хорошими проводниками электричества и тепла.
Эти физические свойства делают щелочные металлы уникальными и полезными в различных областях науки и технологий. Например, они широко применяются в батареях, в сплавах для производства авиационных и космических конструкций, их используют в процессах современной электрохимии и многих других областях.
Щелочные металлы в природе

Щелочные металлы - это группа элементов в таблице Менделеева, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они называются щелочными, потому что они образуют гидроксиды с щелочной реакцией. Щелочные металлы встречаются в природе в различных формах и соединениях.
Литий (Li) является одним из наиболее редких щелочных металлов и встречается в форме минерала сподумен - важного источника лития. Натрий (Na) встречается в природе в виде минералов таких, как галит и полемур, а также в воде океанов и соленых озер. Калий (K) в основном находится в виде минерала сильвин, а также в растениях и почве.
Рубидий (Rb) и цезий (Cs) более редки по сравнению с другими щелочными металлами. Рубидий встречается в некоторых минералах, таких как лепидолит, а также в растениях. Цезий может быть найден в некоторых минералах, таких как полезит, а также в некоторых изотопах в природной форме.
Франций (Fr) является самым редким и радиоактивным щелочным металлом. Он не встречается в природе и может быть получен только через радиоактивный распад других элементов.
Щелочные металлы имеют ряд уникальных свойств, которые делают их ценными ресурсами. Они легко окисляются и образуют соединения с различными элементами. Они также обладают высокой термической и электрической проводимостью, что делает их важными для различных промышленных и технологических приложений.
В общем, щелочные металлы играют важную роль в природе и имеют широкий спектр использования в различных отраслях, от промышленности до медицины. Изучение и понимание их свойств и химических реакций помогает нам получить больше знаний о мире вокруг нас.
Распространенность на Земле
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются одними из самых распространенных химических элементов на Земле. Они входят в состав многих минералов и геологических формаций. В природе они могут быть найдены в виде солей или оксидов, а также в составе воды или почвы.
Наибольшей распространенностью на Земле обладает натрий. Его содержание в земной коре составляет около 2,6%. Он широко распространен в морской воде, почве и растениях. Некоторые из самых известных оксидов натрия – это сода и естественные минералы, такие как галит и трисоли.
Калий также имеет значительное присутствие в природной среде. Его содержание в земной коре составляет около 2,4%. Калий находится преимущественно в виде ионов в почве и воде. Главным источником калия является минерал сильвинит, который содержит около 50% калия.
Литий, рубидий и цезий, сравнительно, встречаются в природе в гораздо меньших количествах. Литий имеет наименьшую распространенность среди щелочных металлов и содержится в земной коре лишь в следовых количествах. Рубидий и цезий чаще можно найти в составе минералов, таких как лепидолит и полевой шпат, но их общая распространенность относительно низка.
Щелочные металлы являются неотъемлемой частью нашей природной среды и имеют множество применений в различных областях, от промышленности и электроники до медицины и сельского хозяйства.
Использование щелочных металлов в промышленности

Щелочные металлы в таблице Менделеева представлены элементами таких химических групп, как группа 1 (протогены) и группа 2 (земноалкалиметаллы). Их основные свойства, такие как высокая реактивность, низкая плотность, низкая температура плавления и высокая проводимость электричества, делают их ценными для использования в различных индустриальных процессах.
Калий и натрий, два наиболее распространенных щелочных металла, используются в производстве огромного количества продуктов. Например, они являются основными компонентами соли, применяемой в пищевой промышленности и в качественом кулинарии. Натрий используется в процессе хлорирования воды для ее очистки и дезинфекции. Калий используется в сельском хозяйстве в виде удобрений, чтобы повысить плодородие почвы и увеличить урожайность.
Щелочные металлы также используются в промышленности для производства батарей и аккумуляторов. Литий, например, является ключевым компонентом литиево-ионных аккумуляторов, которые широко применяются в электронике, мобильных устройствах и электромобилях. Натрий также используется в производстве солевых аккумуляторов и представляет собой одну из наиболее доступных и дешевых альтернативных батарейных технологий.
Кроме того, щелочные металлы широко применяются в промышленности стекла и керамики. Натрий, калий и литий используются в процессе стеклоплавления для придания материалам прочности и устойчивости к высоким температурам. Они также используются для создания специальных стеклянных составов, используемых в лазерной технологии и оптике.
Кроме перечисленных отраслей, щелочные металлы находят применение в производстве чистящих средств, фармацевтики, светотехники и других сферах промышленности. Их широкое использование объясняется их уникальными химическими и физическими свойствами, что делает их ценными и незаменимыми материалами в различных производственных процессах.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы обладают следующими свойствами: высокой химической реактивностью, мягкостью, низкой плотностью, низкой температурой плавления и кипения, способностью образовывать простые ионные соединения, способностью растворяться в воде и образовывать щелочные растворы.
Какие элементы становятся щелочными металлами в таблице Менделеева?
В таблице Менделеева щелочными металлами являются следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
