Щелочные металлы — это элементы периодической таблицы, которые включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они находятся в первой группе, или первом столбце, таблицы Д.И. Менделеева, и имеют один электрон на внешнем слое электронов. Общая характеристика щелочных металлов заключается в том, что все они являются мягкими, легкими металлами, которые легко реагируют с водой и кислородом.
Уникальные свойства щелочных металлов определяются их низкой электроотрицательностью и большим размером ионов. Так, например, водород и щелочные металлы обладают способностью легко образовывать ионы с положительным зарядом, которые становятся частью реакций с другими веществами. Благодаря этой химической активности, щелочные металлы широко используются в различных областях, включая производство алкалиевых аккумуляторов, фармацевтику, производство стекла и многое другое.
Щелочные металлы также проявляют высокую электропроводность и теплопроводность, что делает их ценными для использования в электрических и термических устройствах. Они также являются важными микроэлементами для живых организмов, в том числе для функционирования нервной системы и поддержания баланса воды в организме.
Несмотря на свою ценность и широкое применение, щелочные металлы также имеют некоторые недостатки. Поскольку они являются очень активными химическими элементами, они могут реагировать с влагой или воздухом, что может приводить к коррозии и повреждению. Также, щелочные металлы могут быть токсичными в больших количествах и могут вызывать ожоги при контакте с кожей. Поэтому необходимо соблюдать осторожность при работе с ними.
Определение щелочных металлов и их основные характеристики
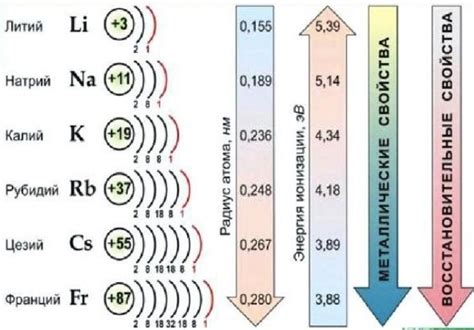
Щелочные металлы – это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе периодической системы химических элементов и характеризуются рядом особых свойств.
Первое из них – это низкая плотность. Щелочные металлы имеют маленькую массу при сравнительно большом объеме. Это делает их легкими и подвижными веществами.
Второе свойство, которое характеризует щелочные металлы, – это их миграционная способность. Такие элементы, как натрий и калий, обладают способностью легко перемещаться в разных средах, например, в воде или в органических соединениях.
Третье важное свойство щелочных металлов – это их деформабельность. Элементы этой группы могут подвергаться пластической деформации без разрушения своей структуры.
Кроме того, щелочные металлы обладают высокой реактивностью. Они активно взаимодействуют с водой, выделяя при этом водород, а также с кислородом, галогенами и другими неорганическими соединениями.
Щелочные металлы также характеризуются низкой температурой плавления и низкими точками кипения. У них обычно низкие значений этих параметров по сравнению с другими металлами и веществами в общем.
В заключение следует отметить, что щелочные металлы обладают положительным окислительным потенциалом, что делает их важными составными частями многих химических реакций и процессов.
Химические свойства щелочных металлов и их реактивность
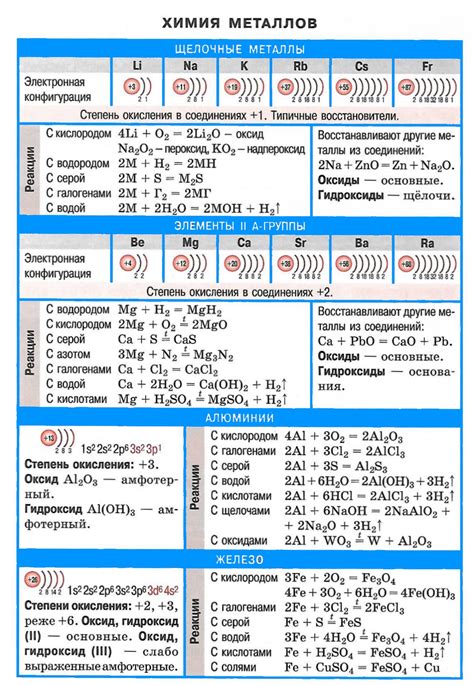
Щелочные металлы, такие как литий, натрий, калий, рубидий, цезий и франций, обладают высокой реактивностью и химической активностью. Они являются самыми активными группой элементов в периодической системе.
Один из основных признаков реактивности щелочных металлов - их способность легко взаимодействовать с кислородом воздуха. При этом образуются оксиды, такие как оксид лития (Li2O), оксид натрия (Na2O) и оксид калия (K2O). Эти оксиды обладают щелочными свойствами и реактивностю, что делает щелочные металлы отличными реагентами в химических реакциях.
Щелочные металлы также реагируют с водой, образуя гидроксиды и выделяя водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия (NaOH) и выделению водорода. Эта реакция происходит очень быстро и сопровождается выделением тепла, что делает ее опасной при неконтролируемом проведении.
Кроме того, щелочные металлы реагируют с многими другими веществами, включая кислоты, галогены и аммиак. Например, реакция натрия с хлором приводит к образованию хлорида натрия (NaCl) - обычной кухонной соли. Использование щелочных металлов в реакциях позволяет получать различные соединения и проводить множество химических синтезов.
Интересным свойством щелочных металлов является их способность образовывать сплавы с другими металлами. Например, легирование железа натрием позволяет улучшить его свойства, такие как коррозионная стойкость и прочность.
Таким образом, химические свойства щелочных металлов и их высокая реактивность делают их полезными для множества химических процессов и применений.
Металл натрий: особенности, применение и свойства

Натрий – химический элемент, обладающий несколькими уникальными свойствами. Он является очень активным металлом, способным реагировать с кислородом и водой. Его атомный номер равен 11, а его атомная масса приблизительно равна 23 г/моль.
Этот металл имеет мягкую, серебристо-белую окраску и хорошо проводит электричество. Натрий обладает низкой плотностью и низкой температурой плавления, что делает его идеальным материалом для производства легких металлических конструкций.
Натрий широко используется в различных сферах промышленности. Он используется в производстве стекла, мыла, моющих средств и многих других продуктов. Он также используется в батареях, поскольку обладает отличной электропроводностью. Кроме того, металл натрий используется в процессе получения алюминия и различных органических соединений.
Свойства натрия делают его подходящим для различных химических реакций. Он легко окисляется при контакте с воздухом, образуя оксид натрия. Натрий также обладает высокой реакцией с водой, при контакте с ней он образует гидроксид натрия и выделяет водород. Способность натрия к образованию соединений с другими элементами делает его полезным материалом в различных процессах.
Химические свойства натрия и его реакция с водой
Натрий является щелочным металлом из группы 1 периодической системы. Он обладает рядом уникальных химических свойств, которые делают его важным элементом в различных сферах нашей жизни.
Одним из основных химических свойств натрия является его активность. Натрий очень реактивен, что проявляется в его способности образовывать соединения с большим количеством элементов. Он легко реагирует с водой, кислородом, галогенами и многими другими веществами.
Особенно интересна реакция натрия с водой. Под воздействием натрия вода начинает активно реагировать, образуя большое количество пузырьков водорода. Выделение водорода происходит из-за того, что при взаимодействии натрия с водой происходит гидролиз, при котором образуются гидроксид натрия и водород.
Реакция натрия с водой является экзотермической, то есть сопровождается выделением большого количества тепла. Это обстоятельство делает реакцию натрия с водой очень опасной, поскольку может вызывать возгорание и выбросы пламени. Поэтому при проведении экспериментов с натрием необходимо соблюдать осторожность и работать в специальных условиях.
Применение натрия в различных отраслях промышленности

Натрий, один из самых распространенных щелочных металлов, нашел широкое применение в различных отраслях промышленности благодаря своим уникальным химическим свойствам.
- Химическая промышленность: натрий используется в производстве различных химических соединений, таких как гидроксид натрия (щелочь), углекислота натрия (сода), натрийцианамид и другие. Эти соединения находят применение в производстве мыла, стекла, пластмасс, алюминия и других важных химических продуктов.
- Металлургическая промышленность: натрий используется для удаления кислорода из металлических окислов в процессе производства алюминия и титана. Он также применяется для очистки металлических поверхностей перед нанесением защитных покрытий.
- Электроэнергетика: натрий используется в батареях с жидкостным электролитом. Благодаря своей реактивности и высокому токоведению, натриевые батареи находят применение в электростанциях для хранения энергии и регулирования нагрузки.
- Пищевая промышленность: натрий находит применение в качестве пищевой добавки (E500) в производстве пищевых продуктов, таких как хлеб, мясные изделия, сыры, соленые орехи и другие. В малых количествах натрий необходим для метаболических процессов в организме человека.
Таким образом, натрий играет важную роль в различных отраслях промышленности, обеспечивая производство химических продуктов, энергетику и пищевую промышленность.
Металл калий: особенности, применение и свойства

Калий - щелочной металл со значительным количеством ценных свойств и характеристик. Обладает серебристо-белым оттенком, является мягким и легкоплавким элементом. Калий является одним из самых активных металлов в таблице химических элементов.
Применение. Калий имеет широкий спектр применения. Он используется в производстве удобрений, так как является необходимым элементом для питания растений. Также, калий используется в металлургической и стекольной промышленности, при производстве сплавов и шлаков, а также в производстве мыла и стекла.
Свойства. Калий обладает рядом уникальных свойств. Он является наиболее реактивным из всех щелочных металлов. Калий реагирует воздухом, образуя оксид и нитрат. При контакте с водой, калий взрывается, выделяя гидроксид калия и водород. Калий обладает хорошей электропроводностью и высокой теплопроводностью.
Полезные свойства. Калий играет важную роль в работе нервной системы и мышц организма. Он участвует в регуляции водного и электролитного баланса, а также в передаче импульсов в нервных клетках. Достаточное количество калия в организме способствует правильному функционированию сердца и снижению риска развития гипертонии и инсульта.
Физические свойства и химическая активность калия

Калий - это щелочной металл с атомным номером 19 в периодической таблице элементов. Он является мягким и легким металлом, который легко режется ножом. В нереактивном состоянии калий имеет серебристо-белый цвет и блестящую поверхность.
Физические свойства калия включают низкую плотность (0,89 г/см³) и низкую температуру плавления (63,2 °C). Калий обладает высокой электропроводностью, что делает его полезным в электротехнике и производстве батареек.
Химическая активность калия определяется его положением в периодической системе элементов. Калий является очень активным металлом, который быстро реагирует с водой, выделяя водород. При взаимодействии с кислородом калий горит ярким пламенем и образует оксид калия.
Калий реагирует с многими кислотами, но самый известный пример его реакции - контакт с хлорной или бромной водой, при котором образуется газообразный хлор или бром и оксид калия.
Интересным свойством калия является его способность окрашивать пламя в фиолетовый цвет. При сжигании калия в атмосфере присутствуют ионы калия, которые обеспечивают фиолетовое отражение света.
Применение калия в сельском хозяйстве и медицине

Калий является одним из самых важных элементов для сельского хозяйства, так как его соединения применяются для удобрения почвы. Калийные удобрения, такие как хлорид калия или сульфат калия, позволяют обеспечить растения необходимым количеством калия, который активно участвует в множестве биохимических процессов в растениях. Благодаря калию усиливается фотосинтез, увеличивается устойчивость растений к стрессовым условиям, таким как засуха или холод, и повышается урожайность.
Калий также имеет важное применение в медицине. Он является неотъемлемым элементом для поддержания нормального функционирования сердечно-сосудистой системы и нервной системы. Калий участвует в передаче нервных импульсов и регулирует сердечный ритм. Врачи часто назначают пациентам, страдающим от гипокалиемии, препараты, содержащие калий, для обеспечения нормальной работы организма.
Кроме того, калий используется для производства различных лекарственных препаратов. Например, калиевые препараты применяются для лечения гипертонии, отеков, аритмии, а также как основной компонент при поддержке работы почек. Однако, необходимо помнить, что употребление калиевых препаратов должно быть согласовано с врачом, так как неправильное использование может привести к повышенному уровню калия в организме и вызвать серьезные проблемы со здоровьем.
Вопрос-ответ

Какие щелочные металлы существуют и какие у них свойства?
Щелочные металлы - это литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы элементов. Главным свойством щелочных металлов является их высокая реактивность. Они активно взаимодействуют с водой, оксидами и галогенами. Также щелочные металлы обладают низкой плотностью, низкой температурой плавления и высокой электропроводностью. Они мягкие, легко режутся ножом и имеют серебристо-белый цвет.
Для чего используют щелочные металлы?
Щелочные металлы имеют широкий спектр применений. Например, литий используется для производства аккумуляторов, натрий используется в пищевой промышленности и в производстве стекла, калий применяется в удобрениях, а рубидий и цезий используются в научных исследованиях и в оптической электронике. Франций является самым редким и радиоактивным щелочным металлом, поэтому его практическое применение ограничено.
Какие опасности связаны с использованием щелочных металлов?
Щелочные металлы могут быть опасными при неправильном обращении. Они реагируют с водой, образуя взрывоопасные газы и воспламеняясь. Кроме того, они также могут вызывать ожоги на коже и раздражение слизистых оболочек. Поэтому при работе с щелочными металлами необходимо соблюдать все меры безопасности, такие как использование защитной одежды и очков, а также работа в хорошо вентилируемых помещениях.
Можно ли найти щелочные металлы на Земле в чистом виде?
Щелочные металлы на Земле обычно не встречаются в чистом виде, так как они очень реактивны и быстро окисляются воздухом. Однако их соединения широко распространены. Например, натрий присутствует в солях, калий - в почве и удобрениях, а литий - в минералах и горных породах. Чистые щелочные металлы можно получить только в лабораторных условиях.
