Оксиды представляют собой важный класс химических соединений, которые играют важную роль в реакциях щелочных металлов. Оксиды щелочных металлов являются результатом реакции металлов с кислородом. В данной статье мы рассмотрим таблицу соединений щелочных металлов с оксидами и особенности таких соединений, которые изучаются в 9 классе.
Щелочные металлы представляют собой группу элементов периодической системы, включающую литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой химической активностью и образуют соединения с различными элементами, включая кислород. Кислород представляет собой самый распространенный элемент на Земле и является сильным окислителем. В результате взаимодействия щелочных металлов с кислородом образуются соединения с оксидами.
Таблица соединений щелочных металлов с оксидами позволяет систематизировать данные о различных оксидах таких металлов. Например, литий образует оксид Li2O, натрий – Na2O, калий – KO2, рубидий – Rb2O и цезий – Cs2O. Реакция взаимодействия щелочных металлов с кислородом мягкая и сопровождается выделением тепла. Образовавшиеся оксиды, как правило, обладают отличной растворимостью в воде и образуют щелочные растворы.
В 9 классе изучается строение и свойства оксидов щелочных металлов, в том числе их растворимость в воде и реакционную активность. Химический эксперимент позволяет учащимся наблюдать реакцию образования оксидов щелочных металлов, а также изучить свойства полученных соединений. Изучение таблицы соединений и описание особенностей реакции помогают закрепить полученные знания и лучше понять роль оксидов в химических процессах.
Щелочные металлы и их свойства

Щелочные металлы являются элементами периодической системы химических элементов. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Одной из основных характеристик щелочных металлов является их мягкость. Вещества, содержащие щелочные металлы, легко удаляются при небольшом воздействии на них.
Щелочные металлы обладают высокой химической активностью. Они реагируют с водой, выделяя водородный газ и образуя щелочные растворы. Кроме того, они активно взаимодействуют с кислородом, образуя оксиды.
Щелочные металлы обладают низким плавлением и кипением. Например, литий плавится при температуре 180,5°C, а кипит при 1347°C. Они также обладают низкой плотностью, что делает их легкими и подходящими для использования в аэрокосмической отрасли.
Щелочные металлы являются хорошими проводниками электричества и тепла. Они образуют ионные соединения с оксидами, которые могут быть использованы в различных отраслях промышленности, например, в производстве стекла или мыла.
В таблице ниже представлены основные свойства щелочных металлов:
| Металл | Символ | Атомная масса | Плотность | Температура плавления | Температура кипения |
|---|---|---|---|---|---|
| Литий | Li | 6.94 | 0.53 г/см³ | 180.5°C | 1347°C |
| Натрий | Na | 22.99 | 0.97 г/см³ | 97.79°C | 892°C |
| Калий | K | 39.10 | 0.86 г/см³ | 63.38°C | 759°C |
| Рубидий | Rb | 85.47 | 1.53 г/см³ | 38.89°C | 688°C |
| Цезий | Cs | 132.91 | 1.93 г/см³ | 28.44°C | 671°C |
| Франций | Fr | 223 | 1.87 г/см³ | 27°C | 677°C |
Соединение металлов и оксидов

Соединение металлов и оксидов является одним из важных процессов в химии. Оксиды металлов представляют собой химические соединения, состоящие из металлического элемента и кислорода. Здесь рассмотрим соединение щелочных металлов (натрия, калия и др.) с оксидами.
Щелочные металлы обладают особенной реакцией с оксидами. Они растворяются в воде, образуя гидроксиды, тем самым проявляя свои щелочные свойства. Например, натрий реагирует с оксидом натрия, образуя щелочь – гидроксид натрия (NaOH).
Соединение металлов и оксидов имеет важное применение в различных областях жизни. Гидроксиды, получаемые из соединения металлов с оксидами, используются в производстве щелочей, стекла и мыла. Кроме того, гидроксиды могут использоваться в лабораториях для регулирования кислотности растворов.
Таблица соединения металлов и оксидов с щелочными металлами позволяет увидеть особенности соединений и их характеристики. В ней можно узнать формулу соединения, название и особенности. Например, соединение натрия с оксидом натрия имеет формулу Na2O и называется "оксид натрия".
- Металл: натрий
- Оксид: оксид натрия
- Формула соединения: Na2O
- Название: оксид натрия
- Особенности: растворяется в воде, образуя щелочь
Таким образом, соединение металлов и оксидов, особенно соединение щелочных металлов с оксидами, играет важную роль в химических процессах. Оно позволяет получать гидроксиды металлов, которые находят широкое применение в различных отраслях промышленности и научных исследованиях.
Таблица соединений металлов и оксидов
Оксиды щелочных металлов:
- Литий (Li2O) - оксид лития
- Натрий (Na2O) - оксид натрия
- Калий (K2O) - оксид калия
Оказание влияния:
Соединения щелочных металлов с оксидами обладают рядом особенностей:
- Происходит образование ионной связи.
- Образование гидроксидов при реакции с водой.
- Оксиды щелочных металлов обладают щелочными свойствами.
- При смешении с кислотами происходит нейтрализационная реакция, сопровождающаяся выделением соли и воды.
Таким образом, таблица соединений металлов и оксидов позволяет увидеть особенности реакций, которые происходят между щелочными металлами и оксидами. Это важное знание для понимания физико-химических процессов и применения соединений в различных областях науки и промышленности.
Особенности соединения щелочных металлов с оксидами
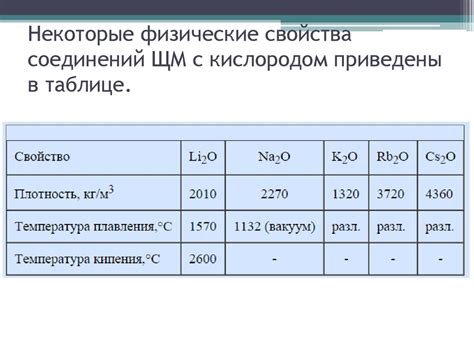
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют особенности в соединении с оксидами, которые обусловлены их химическими свойствами.
Оксиды щелочных металлов обычно имеют простую химическую формулу MO, где M представляет металл. Оксиды щелочных металлов обладают амфотерными свойствами, то есть они могут реагировать как с кислотами, так и с основаниями.
Щелочные металлы реагируют с оксидами, образуя гидроксиды. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH) и освобождая энергию. Эта реакция является экзотермической и может сопровождаться выделением тепла.
Другой особенностью соединения щелочных металлов с оксидами является возможность образования солей. Например, оксид натрия (Na2O) может реагировать с кислотой, образуя соль натрия. Такие реакции особенно полезны в процессе нейтрализации кислотных растворов.
Также стоит отметить, что реакции между щелочными металлами и оксидами могут проходить с высокой реакционной активностью и скоростью. Это связано с тем, что щелочные металлы обладают низкой энергией ионизации и легко образуют положительные ионы.
В таблице ниже представлены основные соединения щелочных металлов с оксидами:
| Щелочный металл (M) | Оксид (MO) | Гидроксид (M(OH)2) | Соль (M(OH)) |
|---|---|---|---|
| Литий | Li2O | Li(OH)2 | LiOH |
| Натрий | Na2O | Na(OH)2 | NaOH |
| Калий | K2O | K(OH)2 | KOH |
| Рубидий | Rb2O | Rb(OH)2 | RbOH |
| Цезий | Cs2O | Cs(OH)2 | CsOH |
Эти особенности соединения щелочных металлов с оксидами играют важную роль в различных химических процессах и имеют практическое применение в разных областях науки и техники.
Использование щелочных металлов в 9 классе

Щелочные металлы являются одной из ключевых тем, изучаемых в 9 классе в рамках предмета "Химия". Эти металлы включают в себя литий, натрий, калий, рубидий и цезий, и они обладают рядом особенностей и применений.
Одним из важных применений щелочных металлов является их использование в производстве щелочных элементов. Щелочные элементы широко используются в различных электротехнических устройствах, таких как батарейки, аккумуляторы и суперконденсаторы. Они имеют высокую электропроводность и способны поставлять большие объемы электроэнергии.
Другим важным применением щелочных металлов является их использование в производстве стекла. Калий и натрий являются основными компонентами стекла, и без этих металлов процесс производства стекла был бы невозможен. Щелочные металлы придают стеклу особую прочность и прозрачность.
Кроме того, щелочные металлы находят применение в медицине. Например, натрий используется в производстве лекарственных препаратов, таких как антациды и соли натрия. Благодаря своим свойствам щелочные металлы могут оказывать лечебный эффект на организм человека.
Таким образом, изучение и использование щелочных металлов является важной частью обучения в 9 классе по химии. Знание об особенностях и применении этих металлов поможет учащимся лучше понять и объяснить ряд явлений и процессов, происходящих как в природе, так и в повседневной жизни.
Обзор экспериментов и практических заданий

Изучение соединения щелочных металлов с оксидами является важной темой в химии. Для более глубокого понимания этого процесса рекомендуется проведение различных экспериментов и выполнение практических заданий.
Один из экспериментов, который можно провести для наглядной демонстрации реакции щелочного металла с оксидом, - это соединение небольшого кусочка натрия с кусочком оксида меди. При этом наблюдается вспышка и образуется соединение натрия с кислородом. Этот эксперимент позволяет увидеть, как происходит реакция щелочного металла с оксидом.
Практические задания могут включать в себя решение химических уравнений, анализ химических реакций и расчеты. Например, студентам могут предлагать составить уравнения реакций между щелочными металлами (натрием, калием или литием) и оксидами (например, оксидом меди или оксидом алюминия). Для решения этого задания необходимо знание химических свойств соединений и умение составлять уравнения реакций.
Для разнообразия, можно предложить студентам выполнить наблюдения за реакцией между оксидом натрия и водой. При взаимодействии щелочи с водой образуется гидроксид щелочного металла (натрия) и выделяется большое количество теплоты. В ходе задания студентам следует наблюдать за процессом, отмечая изменения и описывая реакцию.
Вопрос-ответ

Какие щелочные металлы образуют соединения с оксидами?
Щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs) образуют соединения с оксидами.
Что такое щелочные металлы?
Щелочные металлы - это элементы, которые находятся в первой группе периодической системы. Они характеризуются наличием одного электрона во внешней электронной оболочке, что делает их очень реакционноспособными.
Какие оксиды образуются при взаимодействии щелочных металлов с кислородом?
При взаимодействии щелочных металлов с кислородом образуются оксиды: Li2O, Na2O, K2O, Rb2O и Cs2O.
Чем характеризуются соединения щелочных металлов с оксидами?
Соединения щелочных металлов с оксидами характеризуются следующими особенностями: они являются солью типа М2О, где М - щелочной металл, и имеют кристаллическую структуру. Кроме того, они растворимы в воде и образуют щелочные растворы.
Как можно использовать соединения щелочных металлов с оксидами в практических целях?
Соединения щелочных металлов с оксидами находят широкое применение в практических целях. Например, оксид натрия (Na2O) используется в процессе производства стекла, оксид калия (K2O) применяется в производстве удобрений, а оксид лития (Li2O) используется в производстве литиевых аккумуляторов и лекарственных препаратов.
