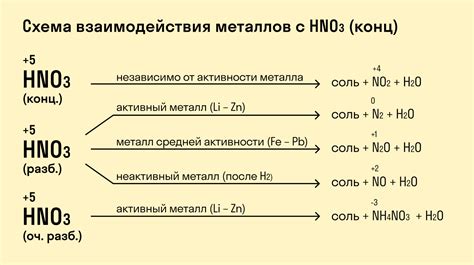
Разбавленная азотная кислота (HNO3) – важное химическое соединение, которое обладает широким спектром применения. Одним из важных аспектов изучения азотной кислоты является взаимодействие этого вещества с металлами. Взаимодействие металлов с азотной кислотой происходит под воздействием окислительного действия кислоты на металл.
Одним из основных свойств разбавленной азотной кислоты является ее активность в отношении металлов. Азотная кислота проникает в металлическую структуру и образует соединения, которые могут снижать металлический блеск и вызывать образование коррозии на поверхности металла. Взаимодействие азотной кислоты с металлами может приводить к образованию оксида металла и выделению нитратных солей.
Необходимо отметить, что взаимодействие металлов с разбавленной азотной кислотой зависит от концентрации кислоты и свойств самого металла. Например, некоторые металлы, такие как цинк и алюминий, обладают высокой активностью и быстро реагируют с азотной кислотой. В то время как другие металлы, такие как золото и платина, обладают высокой устойчивостью и медленно реагируют с кислотой.
Изучение свойств разбавленной азотной кислоты с металлами является важной задачей в химических и научных исследованиях. Взаимодействие азотной кислоты с металлами позволяет получить новые соединения и использовать их в различных областях промышленности и науки.
Вещества при взаимодействии с разбавленной азотной кислотой и металлами

Разбавленная азотная кислота, или азотная кислота с концентрацией менее 60%, проявляет активную реакцию при взаимодействии с металлами. Эта реакция основана на окислительных свойствах азотной кислоты, которая может окислять металлы, запуская реакцию, сопровождающуюся выделением азотных оксидов и образованием солей металлов.
Взаимодействие разбавленной азотной кислоты с металлами происходит достаточно интенсивно, причем скорость реакции зависит от активности металла. Некоторые металлы, такие как алюминий и цинк, реагируют с азотной кислотой достаточно быстро, выделяя при этом обильное количество газообразных азотных оксидов.
В реакции азотная кислота окисляет металлы, превращая их из нейтрального состояния в положительные ионное состояние. Эта реакция часто происходит при образовании солей металлов, которые можно представить в виде ионов и анатомической строение металла. Фактически, реакция азотной кислоты с металлами может быть выражена следующим образом: 3M + 8HNO3 -> 3M(NO3)2 + 4H2O + 2NO↑, где M - металл.
Также важно отметить, что при взаимодействии азотной кислоты с металлами может происходить их некоторая коррозия или разрушение. Это связано с присутствием азотнокислородной среды, которая является агрессивной и способна изменять строение и свойства металлов.
В целом, взаимодействие разбавленной азотной кислоты с металлами является важным аспектом в химической науке и промышленности. Изучение этого процесса позволяет более глубоко понять химические свойства и поведение металлов в различных условиях. Кроме того, данная реакция может иметь практическое применение, например, в создании различных металлических соединений или в процессах очистки металлов от примесей.
Основные свойства разбавленной азотной кислоты

Разбавленная азотная кислота – это химическое соединение, имеющее особенности взаимодействия с различными металлами. Одним из основных свойств разбавленной азотной кислоты является ее кислотность. Контакт с разбавленной азотной кислотой может вызвать ожоги на коже и слизистых оболочках, поэтому при работе с ней необходимо соблюдать меры безопасности.
Разбавленная азотная кислота обладает сильно окислительными свойствами, что является важным аспектом ее взаимодействия с металлами. Она способна реагировать с большинством металлов, вытесняя из их соединений азот и образуя соединения с металлами, такие как нитраты.
Взаимодействие разбавленной азотной кислоты с металлами может сопровождаться выделением газа, например, азотной оксидной, который имеет характерный коричневый цвет и довольно яркий запах. При этом, некоторые металлы могут быть сильно разрушены или растворены в разбавленной азотной кислоте, что связано с их реакцией с окислителями, находящимися в составе кислоты.
Важным свойством разбавленной азотной кислоты является также ее способность образовывать стабильные комплексные соединения с некоторыми металлами. Например, азотная кислота может образовывать нитроцилиндры с железом, которые широко применяются в химической промышленности. Эти соединения обладают высокими взрывоопасными свойствами и используются в качестве взрывчатых веществ.
Химическое взаимодействие металлов с азотной кислотой
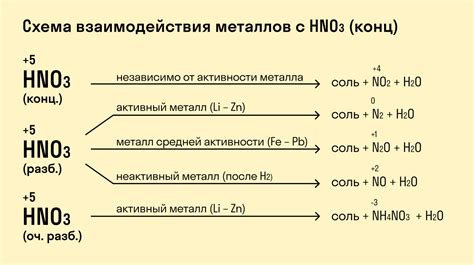
Металлы могут реагировать с азотной кислотой, образуя различные соединения. Например, алюминий при контакте с разбавленной азотной кислотой может образовать нитрат алюминия и обычно сопровождается выделением газа.
Реакция металлов с азотной кислотой может протекать по различным механизмам, в зависимости от конкретных условий. Одним из вариантов является окислительно-восстановительное взаимодействие, при котором один элемент вещества окисляется, а другой восстанавливается.
Реакция с азотной кислотой может быть характерна для различных металлов, включая цинк, железо, медь и др. При этом может образовываться нитрат соответствующего металла. Реакция может протекать достаточно быстро, особенно при использовании концентрированной азотной кислоты.
Важно отметить, что реакция металлов с азотной кислотой может происходить с выделением значительного количества тепла, что может привести к возгоранию или даже взрыву. Поэтому необходимо соблюдать особую осторожность при обращении с этими веществами и выполнять их взаимодействие только в специально оборудованных условиях.
Образование азотистых соединений при взаимодействии с металлами
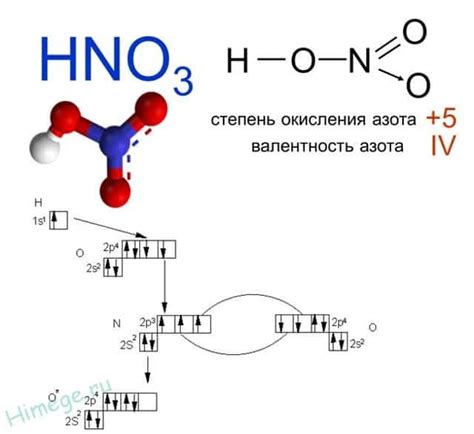
Азотистые соединения - это химические соединения, в состав которых входит азот. При взаимодействии разбавленной азотной кислоты с металлами происходит образование таких соединений. Это явление основано на возможности азотной кислоты действовать как окислитель и проявлять кислотные свойства.
В результате взаимодействия металлов с разбавленной азотной кислотой образуются азотистые соединения, такие как нитраты и азотистые соли металлов. Например, при реакции азотной кислоты с натрием образуется нитрат натрия (NaNO3).
Процесс образования азотистых соединений при взаимодействии с металлами проходит следующим образом: металл вступает в реакцию с азотной кислотой, причем ион металла отдаёт электроны в азотную кислоту, азоту приобретает отрицательный заряд и образует анион. Это позволяет азотистым соединениям проявлять кислотные свойства и образовывать соли с металлами.
Азотистые соединения с металлами имеют важное применение в различных сферах, включая промышленность и сельское хозяйство. Например, нитраты входят в состав удобрений, они обеспечивают растения необходимыми питательными веществами. Кроме того, азотистые соединения находят применение в производстве взрывчатых веществ и пиротехнических изделий.
Специфические свойства взаимодействия различных металлов с азотной кислотой
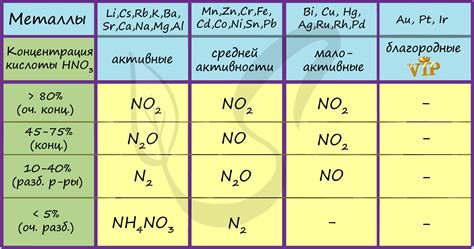
Азотная кислота (HNO3) является сильной оксидирующей кислотой, которая способна взаимодействовать с различными металлами и образовывать соединения, обладающие своими особыми свойствами.
Серебро (Ag) взаимодействует с азотной кислотой, образуя серебряную нитратную соль (AgNO3). Это соединение является растворимым, а его раствор имеет яркую желтую окраску. Серебряная нитратная соль широко используется в лабораториях и в фотографии.
Алюминий (Al) при контакте с азотной кислотой образует сульфат алюминия и аммоний нитрат, что приводит к выделению газа – оксидов азота. Этот процесс является очень быстрым и высокоэкзотермическим, что позволяет использовать азотную кислоту для очистки поверхности алюминиевых изделий.
Железо (Fe) и сталь реагируют с азотной кислотой, образуя нитраты железа (Fe(NO3)3). Железо может присутствовать в разных степенях окисления, что приводит к образованию различных соединений. Реакция между азотной кислотой и железом имеет высокую энергию и может протекать с выделением тепла и образованием паров азотной кислоты.
Медь (Cu) не реагирует с азотной кислотой при обычных условиях. Кислота не оказывает окислительного воздействия на медь, а значит, медь не подвергается разложению в присутствии азотной кислоты. Это свойство меди делает ее предпочтительным материалом для изготовления емкостей, предназначенных для хранения и транспортировки азотной кислоты.
Особенности реакции между азотной кислотой и щелочными металлами
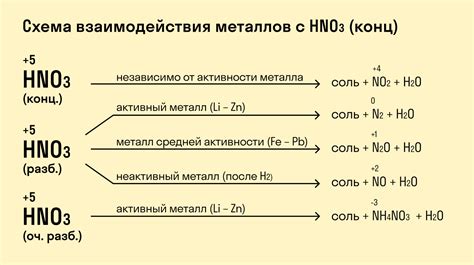
Азотная кислота, или раствор разбавленной азотной кислоты (HN3O), обладает достаточно высоким активным потенциалом, что делает её опасным реагентом. При взаимодействии с щелочными металлами, такими как натрий, калий или цезий, происходит химическая реакция, сопровождающаяся выделением большого количества тепла и образованием нитридов металлов.
В результате реакции азотной кислоты с щелочными металлами образуется натрий или другой металлический нитрид, вода и свободный азот. Эта реакция является экзотермической, то есть сопровождается выделением тепла. Кроме того, она происходит довольно быстро и иногда сопровождается характерными звуковыми эффектами.
В связи с высокой реакционной способностью азотной кислоты и щелочных металлов, она должна проводиться с осторожностью, с соблюдением всех мер безопасности. Реакция может быть использована в лабораторных условиях для получения нитридов металлов или в промышленности для синтеза определенных химических веществ.
Роль азотной кислоты при образовании оксидов металлов
Азотная кислота является сильным окислителем и эффективным агентом при окислительно-восстановительных реакциях с металлами. Одной из важных ролей азотной кислоты взаимодействие с металлами заключается в образовании оксидов металлов. Оксиды металлов — это химические соединения, состоящие из атома металла и атома кислорода.
Взаимодействие азотной кислоты с металлами, такими как цинк, железо, медь и другие, приводит к образованию соответствующих оксидов. Например, при взаимодействии азотной кислоты с цинком образуется цинковый оксид (ZnO), который является бессветным порошком с высокой термической стабильностью.
Азотная кислота, действуя как окислитель, окисляет металлические ионы, которые присутствуют в реакции, до более высоких степеней окисления. При этом азотная кислота сама восстанавливается, образуя оксиды металлов и азотную кислоту в более низких степенях окисления.
Образование оксидов металлов при взаимодействии с азотной кислотой имеет широкое практическое применение. Оксиды металлов используются в производстве различных материалов, катализаторов, пигментов и других химических веществ. Кроме того, они находят применение в электронике, технологии покрытий и многих других областях промышленности.
Значимость взаимодействия металлов с разбавленной азотной кислотой в химической промышленности
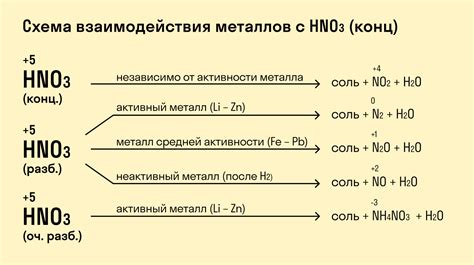
Взаимодействие металлов с разбавленной азотной кислотой является одним из ключевых процессов в химической промышленности. Эта реакция имеет широкое применение, особенно в области производства удобрений.
В результате взаимодействия металлов с разбавленной азотной кислотой образуются нитраты металлов, которые широко используются как компоненты минеральных удобрений. Нитраты обогащают почву необходимыми для растений элементами, такими как азот и калий, что способствует росту и развитию растений.
Кроме того, взаимодействие металлов с разбавленной азотной кислотой может использоваться для получения ряда других важных химических соединений. Например, нитрат калия используется в производстве порошкового взрывчатого вещества, а нитрат натрия применяется в процессе стеклования и производстве огнетушителей.
Также, взаимодействие металлов с разбавленной азотной кислотой играет значительную роль в области очистки промышленных отходов. Реакция с разбавленной азотной кислотой позволяет эффективно удалить тяжелые металлы из сточных вод и отходов, предотвращая загрязнение окружающей среды.
Таким образом, взаимодействие металлов с разбавленной азотной кислотой имеет большое значение в химической промышленности. Эта реакция используется для получения минеральных удобрений, производства взрывчатых веществ, а также для очистки промышленных отходов. Благодаря этому процессу обеспечивается эффективное использование металлов и минимизируется вредное воздействие на окружающую среду.
Вопрос-ответ

Какие свойства имеет разбавленная азотная кислота?
Разбавленная азотная кислота (HNO3) является химическим соединением, которое обладает рядом свойств. Она является бесцветной жидкостью с характерным запахом. HNO3 является сильным окислителем и растворяющим веществом. Она хорошо смешивается с водой и образует азотнокислые (нитрозокислородные) соли, такие как нитраты. Кроме того, разбавленная азотная кислота обладает астрингентными свойствами и может вызывать ожоги при контакте с кожей и слизистыми.
Как происходит взаимодействие разбавленной азотной кислоты и металлов?
Разбавленная азотная кислота может реагировать с различными металлами. При этом образуются нитраты металлов и выделяется диоксид азота (NO2) и водород (H2). Эта реакция протекает в две стадии. Сначала азотная кислота окисляет металл, образуя нитрат металла и освобождая молекулярный кислород. Затем образовавшаяся азотнокислая соль реагирует с водой, образуя азотную кислоту и выделяющаясь диоксид азота и водород.
Какие металлы реагируют с разбавленной азотной кислотой?
Разбавленная азотная кислота может реагировать с разными металлами, включая металлы активных групп периодической системы (например, натрий, калий, кальций), а также некоторые металлы переходных групп (например, железо и цинк). Однако реакция между азотной кислотой и металлами может происходить различными способами в зависимости от конкретных условий и концентрации кислоты.
Какие особенности взаимодействия разбавленной азотной кислоты с металлами?
Особенности взаимодействия разбавленной азотной кислоты с металлами depend on the specific metal and the concentration of the acid. In general, the reaction between nitric acid and metals can be vigorous and exothermic, resulting in the release of gas and heat. Some metals, like copper and silver, do not react with nitric acid because they form a protective layer of oxide on their surface. The reactivity of different metals with nitric acid can also be influenced by other factors such as temperature and the presence of other substances. It is important to handle nitric acid and its reactions with metals with caution due to the potentially hazardous nature of the reactions.
