Соли щелочных металлов, таких как натрий, калий и литий, обладают рядом интересных свойств, которые определяют их поведение в различных условиях. Одним из важных свойств солей щелочных металлов является их растворимость. Растворимость солей щелочных металлов зависит от различных факторов, включая температуру и химическую структуру соли. Некоторые соли щелочных металлов, например, нитраты и хлориды, растворяются легко и образуют прозрачные растворы, в то время как другие соли, такие как карбонаты и гидроксиды, растворяются с трудом и образуют мутные растворы.
Другим важным свойством солей щелочных металлов является их отношение к нагреванию. Многие соли щелочных металлов обладают высокой теплоустойчивостью и могут выдерживать высокие температуры без разложения. Например, нитраты щелочных металлов могут быть подвергнуты нагреванию до высоких температур без потери их структуры и свойств. Это свойство позволяет использовать соли щелочных металлов в различных технических и промышленных процессах, требующих высокой термической стабильности.
Гидролиз - еще одно важное свойство солей щелочных металлов. Гидролиз представляет собой реакцию соли с водой, в результате которой ионизированные частицы соли и воды взаимодействуют, образуя новые соединения. Гидролиз может привести к изменению рН раствора, образованию осадка или изменению ионной активности. Некоторые соли щелочных металлов проявляют сильное гидролитическое действие, что может быть полезно в определенных химических и биологических процессах.
Свойства солей щелочных металлов: растворимость, нагревание и гидролиз
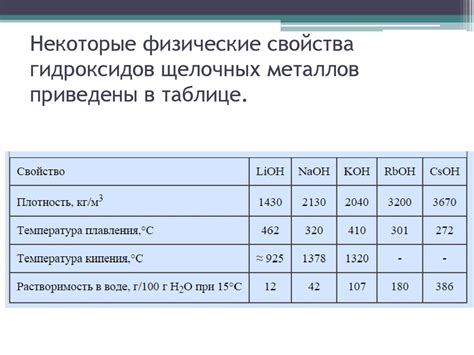
Свойства солей щелочных металлов определяются их структурой и химическими свойствами. Одним из важных свойств солей щелочных металлов является их растворимость. Большинство солей щелочных металлов хорошо растворяются в воде, образуя ионы металла и отрицательные ионы, такие как гидроксиды, карбонаты, нитраты и сульфаты. Однако, есть некоторые соли, которые могут быть нерастворимы в воде и образуют осадок.
Соли щелочных металлов также обладают свойством изменяться при нагревании. Нагревание может приводить к разложению солей, особенно карбонатов и нитратов щелочных металлов. При нагревании карбонаты щелочных металлов декомпозируются на оксиды металлов и углекислый газ, а нитраты щелочных металлов разлагаются на оксид металла, кислород и оксид углерода. Такие реакции являются эндотермическими и сопровождаются поглощением тепла.
Еще одним важным свойством солей щелочных металлов является их способность к гидролизу. Гидролиз - это реакция соли с водой, в результате которой образуются оксиды или гидроксиды металла и кислоты или щелочи. Некоторые соли могут быть гидролизуемыми, что приводит к изменению pH раствора. Например, соли щелочных металлов, содержащие анионы гидроксидов, могут вызывать щелочную реакцию раствора, тогда как соли, содержащие анионы кислотных радикалов, могут вызывать кислую реакцию раствора.
Растворимость солей щелочных металлов
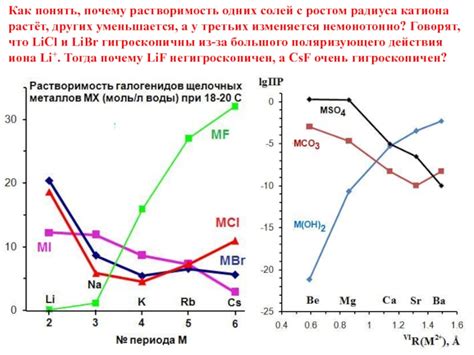
Растворимость солей щелочных металлов составляет основу их реакционной способности. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), образуют соединения с различными кислотами, обладающими разной степенью растворимости. Однако, в общем случае можно сказать, что соли щелочных металлов являются хорошо растворимыми в воде.
Растворимость солей щелочных металлов определяется рядом факторов, включая ионную силу солей, температуру растворения и природу растворителя. Соли щелочных металлов образуют ионные соединения, где металлические ионы положительного заряда образуются из отрицательно заряженных анионов. Это делает их более склонными к растворению в воде, так как вода хорошо сольватирует ионы.
Ряд щелочных металлов имеет особую растворимость в воде. Литий формирует наиболее растворимые соли в своей группе, такие как хлорид лишения (LiCl) и нитрат лишения (LiNO3), которые хорошо растворяются в воде. Соли натрия, калия и других щелочных металлов также обладают хорошей растворимостью. Однако, существуют и нерастворимые соли щелочных металлов, такие как некоторые карбонаты и фосфаты.
Теперь рассмотрим растворимость солей щелочных металлов в необычных растворителях. Они могут быть растворимы или нерастворимы в необычных растворителях в зависимости от их силы связи и природы растворителя. Некоторые соли щелочных металлов имеют низкую растворимость в органических растворителях, таких как этиловый спирт или ацетон. Однако, необходимо учитывать, что растворимость солей щелочных металлов может меняться при изменении условий, таких как температура и наличие других химических веществ в растворе.
Отношение солей щелочных металлов к нагреванию

Соли щелочных металлов, таких как натрий (Na), калий (K) и литий (Li), обладают особым отношением к нагреванию. При нагревании эти соли могут проявлять различные свойства.
Некоторые соли щелочных металлов, например, нитраты и хлораты, при нагревании разлагаются на соответствующие оксиды с выделением кислорода. Это явление называется термическим распадом солей. Например, нагревание нитрата натрия (NaNO3) приводит к образованию оксида натрия (Na2O) и выделению кислорода.
Другие соли щелочных металлов могут быть стабильными при нагревании, однако их свойства могут изменяться. Например, сульфаты щелочных металлов при нагревании теряют кристаллическую структуру и образуют ангидриды – вещества, обладающие кислотными свойствами. Например, сульфат натрия (Na2SO4) при нагревании превращается в ангидрид серной кислоты (SO3), который может реагировать с водой и образовывать серную кислоту.
Некоторые соли щелочных металлов могут также претерпевать гидролиз - реакцию с водой при нагревании. Например, гидроксид натрия (NaOH) при нагревании с водой образует щелочь натрия (NaOH) и воду. При этой реакции может выделяться значительное количество тепла.
Таким образом, отношение солей щелочных металлов к нагреванию может быть различным и зависит от их химического состава и структуры. Эти свойства солей имеют большое значение при их использовании в различных процессах и промышленных производствах.
Гидролиз солей щелочных металлов

Гидролиз солей щелочных металлов — это химический процесс, при котором соли реагируют с водой, расщепляются на ионы и образуются гидроксиды металлов и кислоты или основания. Щелочные металлы входят в первую группу периодической системы и включают литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Гидролиз солей щелочных металлов зависит от того, является ли кислотность водного раствора соли сильной или слабой. Если кислотность сильная, то происходит образование кислоты при гидролизе, и раствор становится кислым. Например, соль хлористого натрия (NaCl) гидролизирует с образованием кислоты соляной (HCl), и раствор становится кислым.
Если же кислотность водного раствора соли слабая, то при гидролизе образуются основания, и раствор становится щелочным. Например, соль карбоната натрия (Na2CO3) гидролизирует с образованием гидроксида натрия (NaOH), и раствор становится щелочным.
Гидролиз солей щелочных металлов играет важную роль в различных процессах и явлениях в природе и в химической промышленности. Например, гидролиз солей используется при производстве мыла и стекла.
Важно отметить, что гидролиз щелочных металлов может быть уменьшен или полностью подавлен путем добавления кислоты или основания к раствору соли.
Кальций как щелочной металл: особенности свойств солей

Кальций является одним из щелочных металлов, и его соли обладают рядом характерных особенностей свойств. Одним из ключевых свойств кальция как щелочного металла является его высокая растворимость в воде. Многие соли кальция легко растворяются в воде, образуя ионные растворы с положительно заряженными катионами кальция и отрицательно заряженными анионами.
Еще одной особенностью свойств солей кальция является их отношение к нагреванию. Многие соли кальция, например, кальций хлорид, могут быть нагретыми без разложения. Это позволяет использовать эти соли в разных технологических процессах, где требуется высокая температура.
Кроме того, соли кальция обладают также свойством гидролиза. В процессе гидролиза соли кальция, растворяющиеся в воде, разлагаются на катионы, обычно кальция, и анионы гидроксида, образуя щелочные растворы. Гидролиз солей кальция вызывает изменение рН растворов и может влиять на их химическую активность и свойства.
Литий в составе солей: уникальные свойства и применение

Литий – легкая химическая элемент, входящая в состав щелочных металлов. Соли лития обладают уникальными свойствами и широко применяются в различных областях науки и промышленности.
Одним из главных свойств солей лития является их растворимость. Соли лития хорошо растворяются в воде, образуя прозрачные растворы. Это делает их удобными для использования в различных процессах, где требуется быстрое и полное растворение вещества.
Еще одним важным свойством солей лития является их отношение к нагреванию. Соли лития выделяют значительное количество тепла при нагревании, что позволяет использовать их как источник тепла в различных процессах. Кроме того, соли лития обладают низкой температурой плавления, что позволяет использовать их в производстве специальных сплавов и покрытий.
Соли лития также имеют особое отношение к гидролизу. Гидролиз – это реакция разложения вещества под воздействием воды. Соли лития гидролизуются слабо, что обусловлено устойчивостью их химической структуры. Это позволяет использовать соли лития в различных процессах, где требуется стабильность вещества при взаимодействии с водой.
Благодаря своим уникальным свойствам, соли лития нашли широкое применение в различных областях. Они используются в производстве лекарственных препаратов, аккумуляторов, стекол и керамики, а также в химической промышленности и ядерной энергетике. Благодаря низкой токсичности и высокой эффективности, соли лития оказывают положительное влияние на различные процессы и продукты.
Потребление солей щелочных металлов в пищевой промышленности

Соли щелочных металлов, такие как натрий и калий, играют важную роль в пищевой промышленности. Они используются в процессе производства различных продуктов для придания им определенных вкусовых и консервирующих свойств.
Одно из основных свойств солей щелочных металлов - их растворимость. Это позволяет легко и быстро добавлять соли в пищевые продукты, такие как соусы, консервы и кетчуп. Благодаря своей растворимости, соли щелочных металлов равномерно распределяются по продукту, придавая ему единый вкус и сохраняя его свежесть.
Еще одно важное свойство солей щелочных металлов - их отношение к нагреванию. Во время приготовления пищевых продуктов соли щелочных металлов сохраняют свои полезные свойства и не теряют вкусовых качеств, несмотря на высокую температуру обработки. Это позволяет создавать различные вариации блюд с использованием солей, сохраняя их натуральный вкус и питательные качества.
Еще одно важное применение солей щелочных металлов - их свойство гидролиза. При контакте с водой соли щелочных металлов разлагаются на катионы и анионы, образуя гидроксиды. Это является преимуществом при производстве различных добавок в пищевой промышленности, таких как стабилизаторы, антиоксиданты и регуляторы кислотности. Гидролиз солей помогает поддерживать оптимальный уровень pH в пищевых продуктах и сохранять их структуру и свежесть в течение длительного времени.
Стоит ли добавлять соли щелочных металлов в пищу - польза и вред

Соли щелочных металлов, такие как натрий и калий, широко используются в пищевой промышленности для придания вкуса и улучшения текстуры продуктов. Однако, вопрос о пользе и вреде таких добавок в пищу остается актуальным и требует более детального рассмотрения.
Во-первых, следует отметить, что неконтролируемое потребление солей щелочных металлов может привести к ряду негативных последствий для здоровья. Высокий уровень потребления натрия может вызывать повышение артериального давления и увеличение риска развития сердечно-сосудистых заболеваний. Кроме того, избыток калия в организме может привести к нарушениям работы сердца и почек.
С другой стороны, щелочные металлы, такие как натрий и калий, являются необходимыми элементами для нормального функционирования организма. Они участвуют в регуляции водно-солевого баланса, поддержании нормального кровяного давления и функционировании мышц и нервной системы.
Потребление солей щелочных металлов в пище должно быть умеренным и контролируемым. Оптимальным вариантом является употребление продуктов, богатых натуральными источниками натрия и калия, такими как овощи, фрукты и зелень. При использовании солей щелочных металлов в приготовлении пищи, следует обращать внимание на их содержание и присутствие в других добавках пищевого процесса.
Выводы о пользе и вреде добавления солей щелочных металлов в пищу должны быть основаны на балансировке и контроле потребления таких добавок. Рекомендуется консультироваться с врачом или диетологом для определения оптимального рациона и ограничения потребления неконтролируемых добавок солей щелочных металлов.
Вопрос-ответ

Как происходит гидролиз солей щелочных металлов?
Гидролиз солей щелочных металлов происходит при контакте с водой. В результате реакции ионов металла с водой образуются гидроксиды и гидроксокомплексы.
Почему соли щелочных металлов обычно хорошо растворяются в воде?
Соли щелочных металлов обычно хорошо растворяются в воде из-за их положительного заряда и малого размера ионов. Это позволяет солью разделиться на ионы и легко диссоциировать в растворе.
Как растворимость солей щелочных металлов зависит от температуры?
Растворимость солей щелочных металлов обычно увеличивается с повышением температуры. Это связано с тем, что при повышенной температуре межионное взаимодействие становится слабее, что способствует лучшему растворению соли.
Как соли щелочных металлов изменяются при нагревании?
Соли щелочных металлов обычно обладают высокой теплостойкостью и при нагревании они плавятся и затем распадаются на оксиды металла и нейтральные вещества.
