Металлы - это особый класс химических элементов, которые обладают рядом уникальных свойств. Изучение свойств простых веществ металлов является важной частью курса химии и является одной из тем, которая регулярно встречается на экзаменах ЕГЭ по химии.
Одно из важных свойств металлов - это их высокая электропроводность. Электроны в металлах легко движутся по кристаллической решетке, что позволяет металлам служить отличными проводниками электричества. Данное свойство особенно важно для применения металлов в различных электронных устройствах и оборудовании.
Ещё одной характеристикой металлов является их высокая теплопроводность. Большое количество свободных электронов в металлах позволяет быстро передавать тепловую энергию от одной частицы к другой. Именно поэтому металлы широко применяются в производстве теплоотводов и радиаторов, а также в инженерии и строительстве.
Некоторые металлы обладают специфическими свойствами, такими как высокая плотность, твёрдость или способность образовывать сплавы с другими металлами. Эти особенности делают металлы незаменимыми для многих промышленных процессов и производств. Важно помнить, что свойства металлов могут изменяться в зависимости от условий окружающей среды, и изучение таких изменений является важной частью химии.
Свойства простых веществ металлов
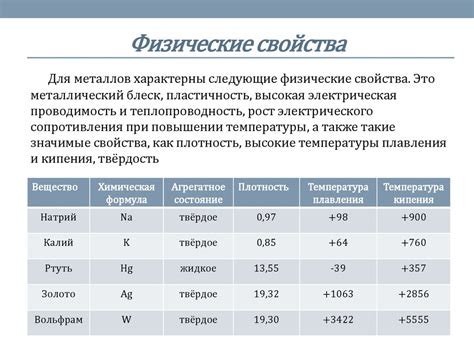
Металлы - это элементы периодической системы, характеризующиеся высокой тепло- и электропроводностью, блеском и способностью образовывать ионы положительного заряда. У металлов имеется множество свойств, обусловленных их структурой и типом химической связи. Важными свойствами металлов являются их пластичность, тугоплавкость, твердость и коррозионная стойкость.
Пластичность - это способность металлов деформироваться без разрушения. Она позволяет получать из металлов различные изделия, в том числе проволоку, листы и трубы. Металлы малой пластичности, например, железо и сталь, используют для производства жестких конструкций, а металлы высокой пластичности, например, алюминий и медь, - для изготовления изделий, требующих гибкости.
Тугоплавкость является свойством металлов с высокой точкой плавления. Например, у платины она достигает 1772 °С, у железа - 1538 °С, а у алюминия – 660 °С. Благодаря этому свойству металлы применяются в высокотемпературных процессах, таких как пайка, сварка и литейное производство.
Твердость металлов объясняется их кристаллической структурой и ковалентной связью. Твердость металлов измеряется по шкале Бринелля или шкале Харднесса. Она влияет на прочность металлов и их способность к износу. Например, титан обладает высокой твердостью и применяется в авиапромышленности, алюминий - низкой твердостью и используется для изготовления упаковочных материалов.
Коррозионная стойкость является важным свойством металлов, определяющим их способность сохраняться в агрессивной среде. Некоторые металлы, например, золото и платина, обладают высокой коррозионной стойкостью и широко используются в ювелирной и химической промышленности. Однако большинство металлов подвержены коррозии и требуют защиты, например, покрытием слоем окиси или использованием антикоррозийных покрытий.
Реакция металлов с кислородом

Металлы взаимодействуют с кислородом, образуя соединения, называемые оксидами. Это происходит благодаря высокой химической активности металлов, которая связана с их способностью отдавать электроны.
В результате взаимодействия с кислородом образуются два основных типа оксидов: основные и кислотные. Основные оксиды образуются при сочетании металла с кислородом. Они обладают щелочными свойствами и растворяются в воде, образуя растворы гидроксидов, т.е. щелочей.
Кислотные оксиды формируются при соответствующем сочетании металлов с кислородом. Они растворяются в воде, образуя кислотные растворы. Металлы, вступая в реакцию с кислородом, изменяют свою окраску. Например, белый цвет соединения у железа меняется на красно-коричневый при образовании оксида железа(III) Fe2O3, а серебряное зеркало, при контакте с кислородом, покрывается темным слоем оксида серебра Ag2O.
Реакции металлов с кислородом имеют не только практическое значение, но и важны для общей теории процессов окисления-восстановления. Реакции с кислородом позволяют определить химическую активность металлов, а также произвести классификацию оксидов.
Свойства металлов в химической связи
Металлы — это химические элементы, обладающие рядом характеристических свойств, в том числе и в химической связи. Одним из основных свойств металлов является возможность образования межатомных связей – металлической связи. Она основывается на свойствах свободных электронов в уровнях энергии металла.
Металлическая связь характеризуется тем, что свободные электроны, находящиеся в зоне проводимости, образуют общий «облако» вокруг положительно заряженных ионов металла. Такое облако свободных электронов позволяет металлам обладать высокой электропроводностью и теплопроводностью.
Кроме того, металлы обладают выраженными механическими свойствами благодаря особой структуре их кристаллической решётки. Эта решётка образована положительно заряженными ионами металла и электронами, находящимися в зоне проводимости. В литых металлах межатомные связи являются безыонными, и потому металл имеет форму, характеризующуюся пластичностью и прочностью.
Одной из особых особенностей металлов в химической связи является их способность образовывать сплавы, то есть смеси двух или более разных металлов. Сплавы обладают улучшенными свойствами по сравнению с отдельными металлами, а их свойства могут быть регулированы путем изменения состава сплава.
Таким образом, металлы обладают рядом уникальных свойств в химической связи, таких как металлическая связь, механическая прочность и пластичность, а также способность образовывать сплавы с улучшенными свойствами.
Реакция металлов с кислотами

Металлы способны реагировать с кислотами, образуя соли и выделяя при этом водород. Эта реакция является типичной для многих металлов и основана на ионном обмене между металлом и кислотой.
Реакция металла с кислотой происходит по следующей схеме: сначала происходит окисление металла, при этом металл отдает электроны и переходит в положительный ион. Затем происходит восстановление протона кислоты, который принимает электроны и переходит в молекулу водорода. В результате образуется соль металла и вода.
Реактивность металлов с кислотами может быть различной, и она зависит от таких факторов, как электроотрицательность металла, его степень окисления и концентрация кислоты. Например, щелочные и щелочноземельные металлы реагируют с кислотами более активно, чем металлы переходных элементов.
Важно учитывать, что некоторые металлы могут реагировать не только с сильными кислотами, такими как соляная или серная кислота, но и с более слабыми, например уксусной или лимонной кислотой. При этом скорость реакции может быть разной и зависит от концентрации и температуры кислоты, а также от свойств самого металла.
Реакция металлов с кислотами имеет довольно широкое применение в различных областях, таких как химическая промышленность и лабораторная практика. Знание свойств металлов и их реактивности с кислотами позволяет контролировать и управлять этими процессами, а также применять их в решении различных задач.
Физические свойства металлов
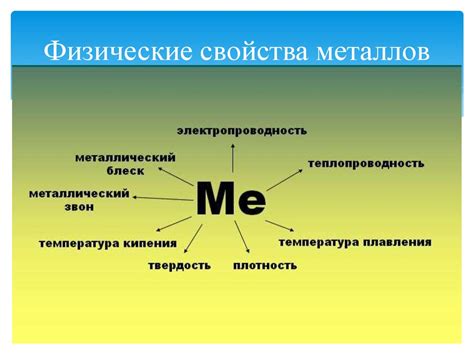
Электропроводность. Одним из основных физических свойств металлов является высокая электропроводность. Это связано с наличием свободных электронов в зоне проводимости, которые могут свободно передвигаться под воздействием электрического поля. Благодаря этому, металлы широко применяются в электротехнике и электронике, а также в производстве проводов и контактов.
Теплопроводность. Металлы обладают также высокой теплопроводностью. Это означает, что они способны эффективно проводить тепло. Благодаря этому свойству металлы широко используются в производстве теплообменных аппаратов, теплоносителей и различных видов оборудования, где требуется эффективное распространение тепла.
Пластичность и податливость. Металлы обладают высокой пластичностью и податливостью, то есть они легко поддаются формоизменению под воздействием механического давления. Благодаря этому свойству, металлы широко используются в металлообработке и производстве изделий различных форм и конфигураций.
Плотность. Металлы обычно обладают высокой плотностью, что в сочетании с их прочностью делает их идеальными материалами для конструкций, подвергаемых большим механическим нагрузкам. Благодаря этому, металлы широко используются в строительстве, авиастроении, машиностроении и других отраслях промышленности.
Точка плавления и кипения. У металлов обычно высокие точки плавления и кипения, что делает их устойчивыми к повышенным температурам. Это позволяет применять металлы в производстве различных видов оборудования, работающего при высоких температурах, например, в энергетике или металлургии.
Реакция металлов с щелочами

Металлы обладают способностью реагировать с различными веществами, включая щелочные растворы. Реакция металлов с щелочами является одной из наиболее распространенных и изучаемых в химии.
Реакция металлов с щелочами происходит по типу обмена и подразумевает образование соли и выделение водорода. Процесс реакции протекает с выделением тепла. Степень активности металла влияет на его способность реагировать с щелочами. Поэтому некоторые металлы, такие как натрий и калий, активно реагируют с щелочами, в то время как другие, например, медь и свинец, сказываются гораздо слабее.
В результате реакции металлов с щелочами образуется соль, которая представляет собой ионное соединение. Соли металлов имеют своеобразные свойства, например, они обладают хорошей проводимостью электрического тока и способностью образовывать кристаллическую решетку.
Реакция металлов с щелочами широко используется в различных отраслях промышленности и научных исследованиях. Например, натрий и калий, благодаря своей активности, широко применяются в промышленности при производстве сплавов, жиров и щелочей. Кроме того, эта реакция является одним из основных методов идентификации металлов и используется в химическом анализе.
Коррозия металлов

Коррозия металлов – это процесс взаимодействия металла с окружающей средой, в результате которого происходит разрушение покрытия и последующая деградация металла. Коррозия является одной из основных причин повреждения металлических конструкций и изделий.
Основными факторами, влияющими на протекание коррозии, являются влага, наличие кислорода, агрессивные химические вещества и уровень окислительно-восстановительного потенциала окружающей среды. Влажная среда и кислород способствуют образованию окислов на поверхности металла, что приводит к разрушению его структуры и появлению коррозионных пятен.
Существуют различные типы коррозии, включая поверхностную, межкристаллическую, межфазную и др. Например, поверхностная коррозия проявляется в виде образования ржавчины на поверхности металла, а межкристаллическая коррозия возникает в результате процессов, разрушающих связи между зернами металла.
Для защиты металлов от коррозии используют различные методы и материалы. Одним из способов является нанесение защитных покрытий, например, пленок из полимеров или перекиси алюминия. Также применяют процессы гальванического покрытия и катодной защиты, которые основаны на изменении потенциала металла и создании защитной электрохимической системы.
Коррозия металлов – важная проблема в инженерии и промышленности. Тщательное изучение причин и механизмов коррозии позволяет разрабатывать эффективные способы защиты металлических конструкций и продлевать их срок службы.
Вопрос-ответ

Какие свойства металлов можно определить с помощью тестов ЕГЭ?
С помощью тестов ЕГЭ можно определить различные свойства металлов, такие как активность, способность реагировать с кислотами, способность проводить ток, плавкость, магнитные свойства и др.
Какой тест позволяет определить активность металлов?
Для определения активности металлов используется тест на реакцию металла с раствором солей других металлов. Если металл замещает другой металл в растворе, то он более активен.
Каким образом можно определить способность металлов реагировать с кислотами?
Для определения способности металлов реагировать с кислотами используется тест на образование газа при контакте металла с кислотой. Если образуется пузырьковый газ, значит металл реагирует с кислотой.
Что определяет способность проводить ток металлов?
Способность проводить ток металлов определяется наличием свободных электронов в их структуре. Металлы, в которых свободных электронов много, обладают высокой способностью проводить ток.
Какой тест позволяет определить степень плавкости металлов?
Для определения степени плавкости металлов используется тест на нагревание металла. Если металл быстро плавится, то его степень плавкости высокая. Если металл плавится медленно или не плавится вовсе, то его степень плавкости низкая.
