Металл является одним из основных строительных блоков материи и обладает уникальными свойствами. Он обладает высокой теплопроводностью и электропроводностью, а также является ковким и пластичным материалом. Металлы могут иметь различные цвета, от белого и серебристого до ярко-желтого и красного. Они также обладают высокой плотностью и тяжелыми свойствами. Металлы встречаются практически повсюду: в постройках, транспорте, электронике и промышленности.
Кислород - это один из ключевых элементов в химии и жизни. Он образует около 21% атмосферы Земли и необходим для существования большинства организмов. Кислород имеет высокую электроотрицательность и может образовывать химические связи с другими элементами, что делает его неотъемлемой частью множества соединений и молекул. Он также является сильным окислителем и может поддерживать горение, что делает его важным элементом в процессе дыхания и сгорания топлива.
Литий - это металл, который обладает низкой плотностью и хорошей электропроводностью. Он имеет малую твердость и является наиболее легким металлом среди всех химических элементов. Литий обладает высокими реакционными свойствами и может образовывать соединения с различными элементами. Он также широко используется в батареях, медицине и ядерной энергетике.
Фосфор - это многочисленный химический элемент, который существует в различных формах. Он имеет высокую реакционную способность и может образовывать соединения со многими другими элементами. Фосфор является ключевым элементом в биологии и обладает большим значением для жизни, так как является составной частью ДНК, РНК и АТФ. Он также используется в производстве удобрений, стекла и промышленных материалов.
Сера - это химический элемент, который обладает разнообразными свойствами. Она может быть представлена в различных модификациях, включая желтую и прозрачную формы. Сера часто используется в промышленности, включая производство удобрений, резиновых изделий, красителей и взрывчатых веществ. Она также является важным компонентом некоторых белков и аминокислот, необходимых для жизнедеятельности организмов.
Свойства металла
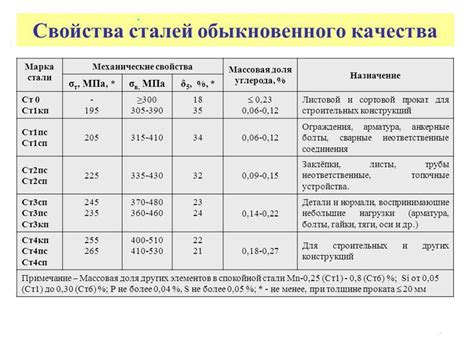
Металлы - это химические элементы, которые обладают определенными свойствами, делающими их идеальными для множества промышленных и технологических приложений. Они обладают высокой теплопроводностью и электропроводностью, что делает их основными материалами для производства проводов, моторов и других электрических устройств.
Металлы также обладают высокой реакционной способностью, и многие из них способны реагировать с кислородом воздуха, образуя оксиды. Некоторые из этих оксидов обладают защитными свойствами и препятствуют дальнейшей коррозии металла. Железо, например, образует оксид железа (ржавчину), которая предотвращает дальнейшую коррозию металла.
Один из ключевых параметров металлов - их пластичность и формоизменяемость. Металлы легко поддаются обработке на различных стадиях производства, включая литье, вальцовку, штамповку и сварку. Благодаря этим свойствам, металлы могут быть приведены во все более сложные формы и использованы для создания широкого спектра изделий и деталей.
Металлы также обладают высокой механической прочностью, что делает их надежными и долговечными материалами для конструкций и механизмов. Они способны выдерживать большие нагрузки и напряжения без разрушения. Кроме того, металлы обладают высокой плотностью, что делает их тяжелыми материалами с большой массой.
Свойства кислорода

1. Физические свойства:
Кислород - газ без цвета, запаха и вкуса. При нормальных условиях (температуре и давлении) кислород не встречается в свободном состоянии на земле, а образует оксиды в различных соединениях. Кислород обладает низкой плотностью и легче воздуха, поэтому воздухом можно считать смесь кислорода и других газов.
2. Химические свойства:
Кислород является очень активным химическим элементом. Он сильный окислитель и легко вступает в реакции с другими веществами. Кислород играет важную роль в горении и дыхании. При сжигании вещества реагируют с кислородом, выделяя большое количество энергии. Кислород также необходим для дыхания живых организмов, включая человека.
3. Реакции с металлами:
Кислород реагирует с большинством металлов, образуя оксиды. Например, при взаимодействии с железом образуется ржавчина (оксид железа). Некоторые металлы реагируют с кислородом очень быстро и даже взрывоопасно.
4. Растворимость:
Кислород плохо растворяется в воде, при этом в водных растворах образуется кислородная кислота (H2O2). Это безцветная жидкость, которая является сильным окислителем и используется как дезинфицирующее средство.
5. Влияние на организм:
Кислород необходим для дыхания живых организмов и выполняет важные функции в организме. Недостаток кислорода может привести к гипоксии (кислородному голоданию), которая негативно сказывается на организме и может вызывать различные заболевания. Высокая концентрация кислорода влияет на организм, вызывая гипероксию и повреждение тканей.
Свойства лития

Литий - это химический элемент из группы щелочных металлов с атомным номером 3. Он имеет мягкую и серебристо-белую металлическую гладкую поверхность. Литий находится в первой группе периодической таблицы, что делает его самым легким металлом.
Физические свойства лития:
- Температура плавления лития составляет около 180 градусов Цельсия, а его температура кипения равна 1347 градусов Цельсия.
- Литий обладает низкой плотностью и является наименьшим по плотности металлом. Его плотность составляет около 0,534 г/см³.
- Он имеет низкую твердость и может быть резан ножом.
Химические свойства лития:
- Литий очень реактивен и горит ярким фиолетовым пламенем воздухе.
- Он растворим в водах и образует щелочной гидроксид.
- Литий также образует соединения с кислородом, серой и фосфором, которые могут быть взрывоопасными.
Литий имеет широкий спектр применений, включая использование в аккумуляторах, лекарствах, стекле и синтезе органических соединений. Он также используется в ядерной энергетике для производства тепловыделяющих стержней.
Свойства фосфора
Фосфор – химический элемент из группы не металлов, обозначается символом P в периодической системе. Он имеет атомный номер 15 и относится к 3-й группе. Фосфор представляет собой низкотемпературный самовозгорающийся элемент, встречающийся в природе в виде минералов и органических соединений, а также присутствующий в живых организмах.
Одним из характерных свойств фосфора является его высокая реактивность. Он образует соединения со многими элементами, такими как кислород, сера, хлор, бром, и др. Фосфор сильно окисляется на воздухе, при этом образуется белый фосфор, который легко воспламеняется. Внешне белый фосфор представляет собой прозрачные или слабо желтые кристаллы.
Фосфор обладает низкой плотностью и низкой температурой плавления, что делает его подходящим для использования в различных промышленных процессах. Он используется при производстве удобрений, фармацевтической продукции, спичек и фосфорных соединений.
Важно отметить, что фосфор является необходимым элементом для жизнедеятельности организмов. Он играет важную роль в образовании ДНК и РНК, энергетическом обмене, передаче генетической информации и других биологических процессах. Без фосфора жизнь, как мы ее знаем, была бы невозможна.
Фосфор имеет также различные изотопы, которые обладают разной стабильностью и используются в научных исследованиях, а также в медицине.
Свойства серы

Сера — химический элемент из группы не металлов. Она обладает рядом уникальных свойств, которые делают ее важным материалом в различных областях промышленности.
Одним из основных свойств серы является ее способность к горению на воздухе. При этом образуется сильно пахнущий газ, который называется пригорюнилым сероводородом. Горение серы может происходить как самоподдерживаемое, так и под влиянием внешнего источника тепла.
Сера также обладает высокой электроотрицательностью, что делает ее хорошим окислителем. Она легко вступает в реакции с многими веществами, например, с металлами, образуя соединения. Благодаря своим окислительным свойствам, сера активно применяется в производстве удобрений, лекарств и красителей.
Еще одним важным свойством серы является ее способность образовывать двойные и тройные связи с атомами других элементов. Это позволяет создавать многочисленные органические и неорганические соединения серы, включая сульфаты, сульфиды и сульфоны. Такие соединения широко применяются в различных отраслях промышленности, включая производство пластмасс, резиновых изделий, огнезащитных материалов и многое другое.
Физические свойства серы

Сера – элемент химического распределения С, иногда называемый каменной серой или серой ада. У серы есть несколько важных физических свойств, которые определяют ее поведение и применение в различных областях науки и промышленности.
Одно из основных физических свойств серы – желтый цвет. Это отличает ее от многих других элементов и делает ее легко узнаваемой. Тем не менее, далеко не все сероводородные соединения имеют желтый цвет, так как они могут быть прозрачными или даже безцветными.
Еще одно важное физическое свойство серы – ее плотность. У серы плотность составляет примерно 2 г/см³, что делает ее тяжелее многих других элементов. Это свойство определяет ее способность легко оседать или выпадать из растворов, что делает ее полезной для различных процессов отделения и очистки в промышленности.
Также сера обладает кристаллической структурой. Ее атомы образуют регулярные, повторяющиеся решетки, что придает сере устойчивость и прочность. Это позволяет ей существовать в различных формах, например, в виде кристаллов или порошка.
И, наконец, важным физическим свойством серы является ее способность к плавлению и затвердеванию. Температура плавления серы составляет около 115 градусов Цельсия, а температура застывания – около 95 градусов Цельсия. Это делает серу полезным материалом для процессов, требующих высокой устойчивости к высоким и низким температурам, например, в области производства стекла и керамики.
Химические свойства серы

Сера – химический элемент с атомным номером 16 и символом S. У серы есть несколько уникальных химических свойств, которые делают ее незаменимой в различных производственных процессах и при производстве разнообразных химических соединений.
Одним из главных химических свойств серы является ее способность образовывать множество разнообразных соединений. Сера может образовывать соединения с металлами, кислотами, аммиаком и другими веществами. Это позволяет использовать серу как исходный материал при производстве многочисленных химических продуктов.
Сера обладает также достаточно высокой реакционной способностью. Она может вступать в реакцию с кислородом и образовывать сернистый и серной кислоты. Также сера может гореть при воздействии открытого пламени и образовывать сернистый и серный диоксид.
Кроме того, сера имеет высокую аффинность к многим другим элементам, таким как водород, фосфор и хлор. Она может реагировать с ними и образовывать соединения с различными свойствами.
Также стоит отметить, что сера является одним из основных компонентов многих природных и искусственных соединений. Она находит широкое применение в производстве удобрений, взрывчатых веществ, лекарств, пищевых добавок и других продуктов.
Вопрос-ответ

Какие свойства металлов?
Металлы обладают рядом основных свойств. Они отличаются высокой электропроводностью, теплопроводностью и пластичностью. Кроме того, металлы имеют блестящую поверхность и способны принимать любую форму при обработке. Они хорошо реагируют с кислородом, образуя соединения, называемые оксидами.
Какие свойства кислорода?
Кислород - химический элемент из группы благородных газов. Он отличается высокой активностью и является очень реактивным. Кислород обладает хорошей растворимостью в воде и является важным элементом для поддержания жизни на Земле. Он не имеет цвета, запаха и вкуса. Кроме того, кислород отличается высокой окислительной способностью.
Какие основные свойства лития?
Литий - металлический элемент, характеризующийся низкой плотностью и хорошей электропроводностью. Он имеет серебристо-белый цвет и мягкую консистенцию. Литий является легким металлом и может быть использован в производстве аккумуляторов и легких конструкций. Важным свойством лития является его способность реагировать с водой и выделяться в виде взрывоопасного газа.
