Металлы - это химические элементы, обладающие такими основными свойствами, как отличная термическая и электрическая проводимость, пластичность и блеск. Однако, помимо этих характеристик, металлы могут также проявлять окислительные или восстановительные свойства.
Окислительная способность металлов заключается в их способности отдавать электроны другим веществам, в результате чего сам металл окисляется. Интересно, что окислительную способность металлов можно предсказать на основе их положения в периодической системе элементов. Чем дальше металл находится слева в периодической таблице, тем сильнее он проявляет свою окислительную активность.
Восстановительные свойства металлов, напротив, проявляются в их способности принимать электроны от других веществ и тем самым восстанавливаться. Особенностью восстановительных свойств металлов является то, что они способны образовывать ионы с положительным ионным зарядом. Восстановительная активность металлов варьируется в зависимости от их положения в периодической таблице, чем дальше металл находится справа, тем сильнее он обладает восстановительной активностью.
Таким образом, свойства металлов, такие как окислительность или восстановительность, связаны с их способностью обмениваться электронами с другими веществами. Окислительные и восстановительные реакции металлов являются важными процессами в химии и имеют множество практических применений, включая производство металлических сплавов, батарей и коррозионную стойкость металлических материалов.
Понимание свойств металлов даёт нам возможность контролировать и использовать их окислительные или восстановительные свойства в различных химических процессах и технологиях, что обеспечивает широкое применение металлов в нашей повседневной жизни.
Окислительные и восстановительные свойства металлов

Металлы проявляют окислительные свойства, когда способны отдавать электроны и образовывать положительные ионы. Окисление представляет собой процесс, при котором металлным атомам необходимо избавиться от своих электронов, что делает металл положительно заряженным.
Окислительные свойства металлов связаны с их электронной структурой. Металлы имеют небольшую энергию ионаризации, что позволяет им легко отдавать электроны и образовывать положительные ионы. Примером металла с ярко выраженными окислительными свойствами является активный металл калий (K), который реагирует с водой, образуя щелочь и выделяя водород.
Восстановительные свойства металлов связаны с их способностью получать электроны и образовывать отрицательные ионы. Восстановление происходит при контакте металла с веществами, способными отдавать электроны. Например, металл натрий (Na) может восстанавливать ионы водорода, разрушая воду на молекулярные компоненты и образуя водородный газ.
Окислительные и восстановительные свойства металлов имеют важное практическое применение. Они используются в химических реакциях, электролизе, гальванических элементах и других процессах, связанных с передачей и переработкой электронов. Понимание этих свойств металлов позволяет контролировать и управлять химическими процессами и создавать новые материалы и технологии.
Что такое окислительные свойства металлов
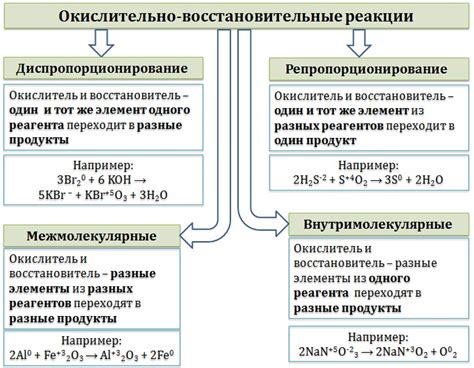
Окислительные свойства металлов – это способность металла принимать электроны и тем самым окислять другие вещества. Окислительные свойства возникают из-за того, что у металлов малая электроотрицательность и относительно низкая энергия ионизации, что позволяет им легко отдавать электроны.
Процесс окисления металлов может происходить в различных условиях. Например, взаимодействие металла с кислотой приводит к образованию ионов металла и водорода:
2HCl + Zn → ZnCl2 + H2
Здесь цинк окисляется, отдавая свои электроны, а водород восстанавливается, принимая эти электроны.
Окислительные свойства металлов играют важную роль в химических реакциях и применяются в различных сферах. Например, алюминий, обладающий сильными окислительными свойствами, используется в производстве взрывчатых веществ и пиротехники. Также многие металлы, имеющие окислительные свойства, применяются в гальваническом покрытии для защиты от коррозии.
Знание окислительных свойств металлов позволяет управлять химическими реакциями и использовать эти свойства в различных областях науки и промышленности.
Что такое восстановительные свойства металлов

Восстановительные свойства металлов - это их способность выступать в качестве восстановителей при химических реакциях. Восстановление - это процесс передачи электронов от вещества с низким окислительным потенциалом (восстановителя) к веществу с высоким окислительным потенциалом (окислителю).
Металлы обладают восстановительными свойствами благодаря особенностям их атомной структуры. У атомов металлов внешний энергетический уровень часто содержит малое количество электронов, что позволяет им эффективно отдавать электроны во время химических реакций.
Одним из примеров восстановительных свойств металлов является их способность снижать окислительный состав вещества. Металл может отдать свои электроны окислителю и тем самым снизить его степень окисления. Этот процесс особенно эффективен при взаимодействии с не металлическими соединениями, такими как кислород, галогены и другие окислители.
- Металлы с высокими восстановительными свойствами, такие как литий и натрий, могут реагировать с водой и выделять водород, а также участвовать в других восстановительных реакциях.
- Восстановительные свойства металлов применяются в различных областях, например, в электрохимии, где металлы используются в качестве восстановителей для положительных ионов.
Восстановительные свойства металлов позволяют им принимать активное участие в химических реакциях, взаимодействуя с окислителями и переходя в окисленное состояние. Это делает металлы важными веществами для проведения различных процессов в природе и промышленности.
Как металлы проявляют окислительные свойства

Металлы являются важной группой химических элементов, обладающих свойствами, позволяющими им проявлять окислительные свойства. Окислительные свойства металлов проявляются в их способности отдавать электроны другим веществам.
В основе окислительных свойств металлов лежит их электронная структура. Металлы характеризуются наличием малого количества электронов во внешней электронной оболочке, что делает их неустойчивыми. Для обретения стабильности металлы стремятся совершить химическую реакцию, в результате которой они отдают электроны, тем самым превращаясь в положительно заряженные ионы.
Окислительные свойства металлов могут быть определены с использованием потенциала окислительно-восстановительных реакций. При взаимодействии металла с веществом, которое способно принять электроны и восстановить металлический ион, металл проявляет окислительные свойства. При этом металлический ион снижает свою энергию и становится более стабильным.
Окислительные свойства металлов также могут быть связаны с их положением в периодической системе химических элементов. Чем больше атом металла, тем больше он имеет энергии для отдачи электронов, что усиливает его окислительные свойства. Кроме того, на окислительность металлов может влиять такой фактор, как их электроотрицательность: чем меньше электроотрицательность металла, тем больше его окислительные свойства.
Как металлы проявляют восстановительные свойства

Восстановительные свойства являются одной из характеристик металлов, которые позволяют им участвовать в химических реакциях, протекающих восстановлением различных веществ.
Восстановление - это процесс, при котором вещество получает электроны и, следовательно, увеличивает свою окислительную способность. Металлы, обладая свободными электронами в своей валентной зоне, способны передавать их другим веществам, проявляя восстановительные свойства.
Восстановительные свойства металлов обусловлены их атомной структурой. На жатом уровне атомы металлов имеют малое количество электронов в своей валентной зоне, что делает их электронною конфигурацию нестабильной. Используя свободные электроны на внешней оболочке, металлы стремятся достичь более устойчивого состояния путем отдачи электронов другим веществам, которые проявляют окислительные свойства.
Проявляя восстановительные свойства, металлы могут участвовать в различных химических реакциях. Например, они могут реагировать с кислородом и образовывать оксиды металлов. Это может происходить при обычных условиях или при повышенной температуре. Кроме того, металлы могут вступать во взаимодействие с растворами солей или веществами, содержащими активные группы.
Таким образом, восстановительные свойства металлов позволяют им выполнять различные функции в химических реакциях и важны для понимания их взаимодействий с другими веществами.
Вопрос-ответ

Какие свойства металлов определяют их способность проявлять окислительные или восстановительные свойства?
Окислительные или восстановительные свойства металлов зависят от их электрохимической активности. Металлы с более низкими значениями электрохимического потенциала имеют большую склонность к окислению (проявление окислительных свойств), в то время как металлы с более высокими значениями электрохимического потенциала имеют большую склонность к восстановлению (проявление восстановительных свойств).
Как электрохимическая активность металлов влияет на их окислительные и восстановительные свойства?
Электрохимическая активность металлов определяет их способность вступать в реакции окисления и восстановления. Металлы с более низкой электрохимической активностью (такими как цинк или железо) проявляют окислительные свойства, то есть способность отдавать электроны и вступать в окислительные реакции, например, образование ионов металла. Металлы с более высокой электрохимической активностью (такими как натрий или калий) проявляют восстановительные свойства, то есть способность принимать электроны и вступать в реакции восстановления, например, образование ионов гидроксида.
Почему металлы с меньшим электрохимическим потенциалом проявляют окислительные свойства?
Металлы с меньшим электрохимическим потенциалом имеют большую склонность отдавать электроны. Окислительные свойства металлов обусловлены их способностью выступать в качестве окислителя во взаимодействии с другими веществами. При окислении металл отдает электроны, образуя положительные ионы. Проявление окислительных свойств у металлов с низким электрохимическим потенциалом связано с их способностью образовывать более стабильные положительные ионы в процессе окисления.
