Химические реакции с участием металлов являются одним из основных объектов исследования в области химии. Металлы являются ключевыми элементами периодической системы, и их химические свойства играют важную роль в многих процессах. Одной из особенностей химических реакций с участием металлов является их способность к окислительно-восстановительным реакциям.
Металлы обладают высокой активностью и отдают электроны в реакции окисления. Они способны образовывать ионы металла положительной валентности или соединения с отрицательной валентностью. Такие реакции часто происходят в контакте с реагентами, обладающими высокой электроотрицательностью, такими как кислород или неметаллы.
Одной из наиболее известных особенностей реакций металлов является образование оксидов. Многие металлы способны образовывать оксидные соединения с кислородом. Это происходит в результате окисления металла в присутствии кислорода. Образование оксидов может иметь как положительный, так и отрицательный эффект на металлы - в зависимости от конкретной реакции и условий окружающей среды.
Химические реакции с участием металлов: особенности и примеры
Металлы являются важной группой веществ в химии и имеют специфические свойства. Одной из особенностей химических реакций с участием металлов является их способность образовывать ионы путем отдачи электронов. Это связано с тем, что металлы имеют низкую электроотрицательность и высокую ионизационную энергию. Также металлы обладают способностью реагировать с другими веществами, образуя различные соединения.
Примером химической реакции с участием металлов является реакция между металлом меди (Cu) и кислородом (O2) при нагревании. В результате образуется оксид меди (CuO). Это типичная реакция окисления металла, где металл отдает электроны и образует положительный ион (купрум), а кислород получает электроны и образует отрицательные ионы. В данной реакции окислительным агентом выступает кислород, а восстановителем - медь.
Второй пример химической реакции с участием металлов - реакция между цинком (Zn) и серной кислотой (H2SO4). При этом образуется сульфат цинка (ZnSO4) и выделяется водород (H2). В данной реакции цинк замещает водород в серной кислоте, что указывает на его более высокую активность и химическую активность по сравнению с водородом.
Особенности химических реакций с участием металлов также связаны с их способностью образовывать специфические соединения, такие как стехиометрический кислород и соединения с кислородсодержащими анионами. На основе этих особенностей и свойств металлов развиваются различные методы синтеза новых веществ и материалов.
Металлы: основные свойства и классификация

Металлы - это класс элементов, обладающих рядом характерных свойств. Одним из главных свойств металлов является их способность проводить электричество и тепло. Благодаря этому свойству металлы широко используются в электронике и в производстве теплопроводящих материалов.
Еще одним важным свойством металлов является их гибкость и пластичность. Металлы легко обрабатываются и могут принимать различные формы, что делает их незаменимыми материалами в сфере строительства и машиностроения.
Металлы подразделяются на несколько классов в зависимости от их физических и химических свойств. В классической классификации металлы делятся на щелочные, щелочноземельные, переходные и другие. Щелочные металлы, такие как литий, натрий и калий, характеризуются высокой реактивностью и встречаются в природе в виде соединений.
Щелочноземельные металлы, например магний, кальций и стронций, тоже являются химически активными и встречаются в природе в виде соединений. Они часто используются как легирующие элементы в производстве сплавов.
Переходные металлы, такие как железо, цинк и медь, обладают большой прочностью и стойкостью к коррозии. Они широко применяются в производстве стальных и медных изделий.
Химические реакции металлов с кислотами
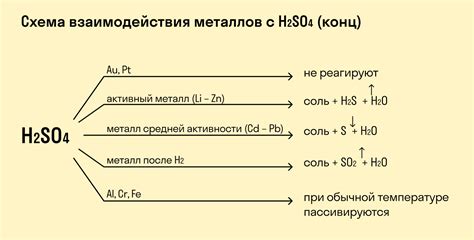
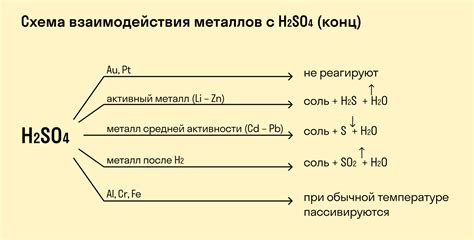
Химические реакции металлов с кислотами являются одним из основных типов реакций в химии. При взаимодействии металла с кислотой происходит образование соли и выделение водорода. Эта реакция особенно активна для активных металлов, таких как натрий, калий или магний.
Процесс реакции металла с кислотой можно описать следующей химической формулой: металл + кислота → соль + водород. Например, при реакции металла меди с соляной кислотой образуется соль меди хлорида и выделяется водород.
Скорость реакции металлов с кислотами зависит от их активности. Наиболее активные металлы, такие как литий или калий, реагируют с кислотами чрезвычайно быстро, иногда даже с проявлением огня или взрыва. Менее активные металлы, например, цинк или железо, реагируют медленнее, но также образуют соли и выделяют водород.
Химические реакции металлов с кислотами имеют практическое значение. Например, используя реакцию металла с кислотой, можно получить водород, который широко применяется в различных отраслях, включая энергетику и производство.
Взаимодействие металлов с водой

Вода активно взаимодействует с многими металлами, при этом происходят химические реакции, которые могут иметь различные последствия для металла и окружающей среды. При взаимодействии с металлами вода может выступать как окислитель или восстановитель.
Вода может окислять металлы, образуя металлические оксиды или гидроксиды. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водород. Подобные реакции можно наблюдать с металлами группы щелочных металлов, таких как литий, калий и т. д.
Однако не все металлы реагируют с водой. Некоторые металлы, например, золото и платина, практически не взаимодействуют с водой. Это связано с их химической инертностью и стабильностью.
Также вода может служить восстановителем в реакциях с некоторыми металлами. Например, железо может быть восстановлено водой при реакции с кислородом, что приводит к образованию ржавчины.
Взаимодействие металлов с водой является важным аспектом не только в химии, но и в промышленности и повседневной жизни. Это позволяет использовать металлы для получения полезных веществ или как источник энергии в батареях и аккумуляторах, а также может приводить к образованию нежелательных отложений и коррозии.
Металлы в реакциях с кислородом и окислителями

Металлы обладают способностью реагировать с кислородом и окислителями, что приводит к образованию оксидов металлов. Эти реакции происходят в различных условиях и имеют важное практическое применение.
Один из типичных способов реакции металлов с кислородом - горение. Во время горения металл окисляется, то есть связывается с кислородом из воздуха. Горение металлов происходит с выделением тепла и света. Некоторые металлы горят с ярким пламенем, например, магний. Горение металлов активно используется в промышленности и быту при сварке и пайке.
Металлы также реагируют с кислородом при нагревании в окислительной среде. В результате таких реакций образуются оксиды металлов. Например, железо при нагревании на воздухе окисляется до Fe3O4 - оксида железа (II,III).
Реакции металлов с окислителями позволяют получать различные металлические соединения. Например, реакция алюминия с хлорной кислотой дает алюминий хлорид и образует соляную кислоту. Такие реакции находят применение в синтезе химических соединений и процессах производства металлов и их сплавов.
Металлы и галогены: образование солей

Взаимодействие металлов с галогенами, такими как фтор, хлор, бром и йод, является характерным случаем химической реакции, в результате которой образуются соответствующие соли. Галогены представляют собой элементы VII группы периодической системы, которые обладают высокой реакционной способностью.
При контакте металла и галогена происходит обмен электронами, в результате чего происходят окислительно-восстановительные реакции. Металлы, в качестве окислителя, отдают электроны галогенам, они же выступают в качестве восстановителя и принимают эти электроны, образуя ионы.
Образование солей при взаимодействии металлов с галогенами происходит следующим образом: металл отдаёт электроны галогену, ионы металла катионы, ионы галогена анионы. Так образуются ионы солей, которые называются галогенидами металлов. Например, хлорид натрия (NaCl), бромид калия (KBr), йодид железа (FeI2).
Образование солей при взаимодействии металлов с галогенами является важным процессом в химической промышленности и науке. Галогениды металлов широко применяются в различных областях, включая производство лекарств, пластмасс, красителей, водопроводных систем и т.д.
Осаждение металлов: электрохимические процессы
Осаждение металлов является одним из важнейших процессов в химии и металлургии. В основе этого процесса лежит электрохимическая реакция, при которой металлы осаждаются на поверхности электрода.
Осаждение металлов осуществляется путем проведения электрического тока через раствор солей металлов. При этом на катоде, то есть на отрицательно заряженном электроде, происходит редукция металлических катионов, а металлы выделяются в виде осадка на поверхности электрода. На аноде, положительно заряженном электроде, происходит окисление анионов или металла, образуя растворимые ионы.
Одной из особенностей электрохимического осаждения металлов является возможность контролировать толщину осажденного металлического слоя. Это достигается путем регулирования величины тока и времени, в течение которого осуществляется осаждение. Таким образом, электрохимическое осаждение позволяет получать металлические покрытия с заданными свойствами.
Электрохимическое осаждение металлов находит широкое применение в различных отраслях промышленности. Например, оно используется в гальваническом производстве для нанесения защитных и декоративных покрытий на поверхности различных изделий. Кроме того, электрохимическое осаждение применяется в процессах электролиза, получения металлов из металлических руд и отходов производства, а также для создания электронных и микроэлектронных устройств.
Термические реакции металлов: примеры и их применение

Термические реакции являются одним из основных типов химических реакций металлов. Они происходят при нагревании металлического вещества до определенной температуры и взаимодействия его с другими химическими веществами. Термические реакции металлов часто используются в промышленности и научных исследованиях.
Одним из примеров термической реакции металлов является термическое распадание оксида металла. В результате нагревания металлического оксида, например, оксида меди, происходит его разложение на металлический медь и кислород. Такая реакция широко применяется для получения чистых металлов, а также в производстве электроники и металлургии.
Еще одной важной термической реакцией металлов является термическое окисление металла. При нагревании металлического вещества в присутствии кислорода происходит образование оксида металла. Примером такой реакции может служить окисление железа в результате его нагревания на воздухе. Термическое окисление металла широко используется для защиты поверхности металлических изделий от коррозии.
Термические реакции металлов имеют широкое применение в различных областях. Они используются в металлургии для получения чистых металлов, в производстве электроники для создания полупроводниковых материалов, в химической промышленности для получения химических соединений и многих других областях. Понимание и использование термических реакций металлов является важным для развития новых материалов и технологий.
Вопрос-ответ

Какие металлы могут участвовать в химических реакциях?
Множество металлов могут участвовать в различных химических реакциях. Некоторые из самых распространенных металлов, которые проявляют активность в реакциях, включают алюминий, железо, медь, цинк и многое другое. Каждый металл имеет уникальные свойства и способности, что определяет их участие в различных химических реакциях.
Какие особенности металлов делают их активными в химических реакциях?
У металлов есть ряд особенностей, которые делают их активными в химических реакциях. Одна из таких особенностей - низкая ионизационная энергия, что означает, что металлы легко отдают электроны. Кроме того, металлы также имеют тенденцию образовывать положительные ионы, так как у них мало электронов во внешнем электронном оболочке. Это делает металлы способными к реакциям с веществами, которые имеют доступные для донорства электроны.
Какие реакции могут происходить с участием металлов?
С участием металлов могут происходить различные химические реакции. Некоторые из наиболее распространенных типов реакций с участием металлов включают реакции окисления-восстановления, образование металлических сплавов, реакции с кислотами и основаниями, реакции с галогенами и многие другие. Каждая из этих реакций имеет свои особенности и условия протекания.
Какие факторы могут влиять на скорость химических реакций с металлами?
Скорость химических реакций с металлами может зависеть от нескольких факторов. Одним из основных факторов является активность металла, то есть его способность взаимодействовать с другими веществами. Насыщенность раствора, температура реакционной среды, концентрация реагентов, наличие катализаторов - также могут оказывать влияние на скорость реакции. Каждый из этих факторов может изменяться и влиять на характер реакции металла с другими веществами.
