Электролиз является важным процессом для получения металлов и других веществ. Он основан на использовании электрического тока для разложения веществ на положительно и отрицательно заряженные ионы. Металлы играют особую роль в электролизе благодаря своим уникальным свойствам и химическим реакциям, которые возникают в процессе.
Одним из основных свойств металлов при электролизе является их способность вступать в реакцию с веществами, образующими электролит. Во время электролиза металлы вступают в реакцию с отрицательно заряженными ионами, благодаря чему они откладываются на катоде. Свойство металлов интенсивно взаимодействовать с другими веществами создает условия для получения чистого металла в результате электролиза.
Кроме того, металлы обладают высокой электропроводностью, что позволяет использовать их в качестве электродов в процессе электролиза. Электроды из металла проводят электрический ток, не подвергаясь разложению и устойчиво функционируя на протяжении всего процесса. Благодаря этому, металлы активно используются в промышленности для проведения электролиза и производства различных веществ, таких как алюминий, медь, серебро и другие.
Металлы и их свойства при электролизе

Металлы обладают рядом особенных свойств, которые проявляются при проведении электролиза. Одним из таких свойств является высокая электропроводность металлов. Благодаря этому свойству металлы успешно применяются в процессе электролиза для передачи электрического тока.
Кроме высокой электропроводности, металлы обладают таким свойством, как низкое сопротивление электролизу. Это означает, что металлы легко окисляются и восстанавливаются в процессе электролиза. Низкое сопротивление позволяет быстро проходить электрический ток через металл, что способствует более эффективному проведению электролиза.
Еще одним важным свойством металлов при электролизе является их способность образовывать ионы. Металлы способны отдавать или принимать электроны, что позволяет им участвовать в реакциях электролиза. Образовавшиеся ионы металлов перемещаются под действием электрического поля и участвуют в реакциях окисления и восстановления.
Свойства металлов при электролизе находят широкое применение в различных областях. Например, электролиз металлов используется в производстве алюминия, цинка, никеля и других металлов. Также электролиз металлов применяется в гальванических процессах, в производстве аккумуляторных батарей и других электрохимических устройствах.
Окисляемость и редуцируемость металлов

Окисляемость и редуцируемость являются важными свойствами металлов при проведении электролиза. Окисляемость определяет способность металла подвергаться окислительным реакциям, то есть отдавать электроны и образовывать положительные ионы. Редуцируемость, напротив, показывает способность металла принимать электроны и образовывать отрицательные ионы.
Основным применением этих свойств является электрохимическая обработка различных материалов, таких как металлы, полупроводники, сплавы и другие. Путем изменения условий электролиза, таких как напряжение, температура и состав электролита, можно контролировать процессы окисления и восстановления металлов.
Также окисляемость и редуцируемость металлов используются при проведении гальванических и электролитических процессов. Гальванические элементы, такие как батарейки, работают на основе разности в окисляемости и редуцируемости металлов, что позволяет получить электрическую энергию.
Кроме того, электролиз может использоваться для покрытия предметов слоем металла, что повышает их стойкость к коррозии и придает им дополнительные эстетические свойства. Например, золочение или посеребрение предметов в ювелирной и часовой промышленности часто проводится с помощью электролиза.
Электропроводность металлов

Электропроводность - основное свойство металлов, которое обусловлено их структурой и особенностями электронной структуры. Благодаря этому свойству, металлы обладают способностью проводить электрический ток.
Внутри металла имеется сеть кристаллической решетки, в которой свободно перемещаются электроны, образуя электронное облако. За счет этого, металлы являются хорошими электропроводниками.
Металлы обладают высокой электропроводностью благодаря наличию большого количества свободных электронов, которые легко двигаются внутри металлического кристалла. Электроны могут передвигаться под воздействием электрического поля, образуя электрический ток.
Электропроводность металлов имеет множество практических применений. Металлы широко используются в электротехнике, электронике, в производстве проводников и электрических контактов. Также, металлическая электропроводность играет ключевую роль в электролизе, позволяя проводить различные химические процессы.
Растворимость металлов в электролите
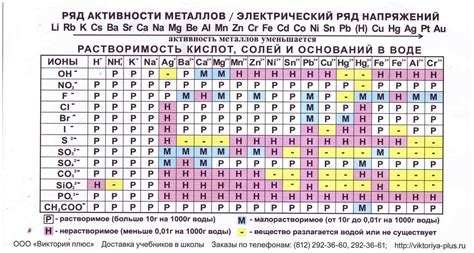
Растворимость металлов в электролите является важным свойством, которое определяет их способность быть использованными в процессе электролиза. Существует различная растворимость различных металлов, и это свойство может быть использовано для получения различных продуктов или обработки материалов.
Некоторые металлы, такие как натрий и калий, обладают высокой растворимостью в электролите. Они легко и быстро растворяются, что позволяет эффективно использовать их во время электролиза. Другие металлы, такие как серебро и золото, имеют низкую растворимость и могут накапливаться в электролите в виде осадка.
Растворимость металлов в электролите также может варьироваться в зависимости от разных условий, таких как температура, рН и концентрация электролита. Это позволяет контролировать процессы электролиза и получать желаемые результаты.
Использование растворимости металлов в электролите имеет много применений. Например, в производстве алюминия металл разлагается при электролизе расплавленного алюминия, тогда как оксиды других металлов, таких как железо и магний, не разлагаются и остаются в качестве осадка.
Также растворимость металлов позволяет получать специфические продукты электролиза. Например, при электролизе раствора меди можно получить медные ионы, которые могут быть использованы для получения медных изделий или в других промышленных процессах.
В целом, растворимость металлов в электролите является важным фактором, который позволяет контролировать и управлять процессами электролиза для получения нужных продуктов и материалов.
Проведение электролиза с использованием металлов
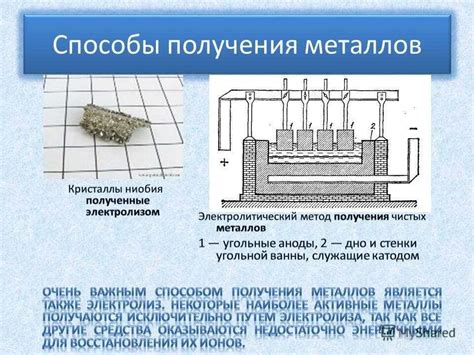
Электролиз – это процесс разложения вещества на ионы под действием электрического тока. Проведение электролиза с использованием металлов позволяет получать чистые металлы, а также осуществлять ряд других полезных процессов.
Одним из основных применений электролиза с использованием металлов является получение металлических покрытий. При этом на детали наносится тонкий слой металла, что способствует улучшению их защитных свойств, повышению эстетического вида и увеличению срока службы.
Еще одним важным применением является электролиз морской воды. При этом происходит разложение воды на водород и кислород, что позволяет получать важные химические элементы для различных отраслей промышленности, а также энергетики.
Также электролиз с использованием металлов используется для извлечения редких и драгоценных металлов из руд. При этом происходит отделение ценных компонентов от сопутствующих примесей, что является важным этапом в их производстве.
Кроме того, электролиз с использованием металлов применяется в процессе очистки сточных вод и зольных отходов. Это позволяет не только уменьшить загрязнение окружающей среды, но и получить полезные вещества из отходов.
Получение чистых металлов методом электролиза

Метод электролиза является одним из наиболее эффективных способов получения чистых металлов. Он основан на использовании электрического тока для разложения соединений металлов на ионы и их последующего осаждения на электроды.
Электролиз может быть проведен в водных или неводных растворах, а также при использовании расплавов. При этом, вода или раствор используются в качестве электролита, который обеспечивает проводимость тока и перенос ионов металла.
Процесс электролиза контролируется с помощью анодов и катодов, которые изготавливаются из различных материалов в зависимости от вида металла, который требуется получить. Аноды обеспечивают окисление соединений металла, а катоды — их восстановление.
Основным преимуществом электролиза является получение чистых металлов высокой степени чистоты. Этот метод позволяет удалять примеси и загрязнения из исходного материала, что делает окончательный продукт идеальным для использования в различных отраслях промышленности, таких как электроника, строительство и машиностроение.
Важно отметить, что электролиз является эффективным и экологически безопасным способом получения металлов. Он позволяет перерабатывать отходы, содержащие металлы, и использовать их повторно, что способствует экономии ресурсов и снижению вредного воздействия на окружающую среду.
Применение металлов в электролизе различных веществ
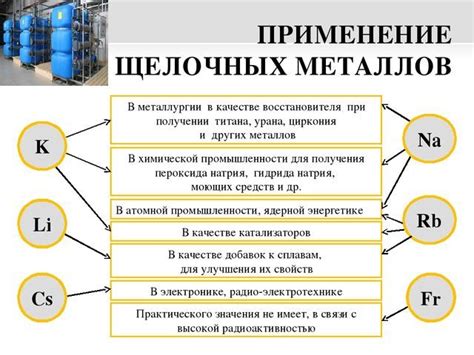
Металлы играют важную роль в электролизе различных веществ и находят широкое применение в этом процессе. Благодаря своим уникальным свойствам, они позволяют эффективно разлагать и получать различные соединения.
Одним из самых распространенных металлов, применяемых в электролизе, является медь. Этот металл используется для получения медной соли и медного металла. Он обладает высокой электропроводностью и стабильностью, что позволяет проводить электролиз с высокой эффективностью.
Алюминий также широко используется в электролизе. Он используется для получения алюминия из его солей и растворов. Алюминий обладает низкой плотностью и коррозионной стойкостью, что делает его отличным выбором для процессов электролиза.
Еще одним важным металлом, применяемым в электролизе, является железо. Оно используется для получения различных соединений железа, включая железную руду и воду. Железо обладает высокой стойкостью к коррозии и хорошей проводимостью, что делает его идеальным для электролитических процессов.
Кроме того, металлы, такие как цинк, никель и свинец, также находят применение в электролизе для получения различных веществ. Они обладают нужными химическими свойствами и проводимостью, что делает их полезными в процессах электролиза.
В целом, металлы играют важную роль в электролизе различных веществ и позволяют эффективно проводить процессы разложения и получения различных соединений. Их свойства и уникальные химические особенности делают их незаменимыми в этом процессе.
Вопрос-ответ

Какие свойства металлов проявляются при электролизе?
При электролизе металлы проявляют такие свойства, как проводимость электричества, жидкотекучесть и реактивность. Они позволяют металлам выступать в роли электродов и подвергаться различным процессам электролиза.
Какие особенности электролиза металлов можно выделить?
Одной из особенностей электролиза металлов является их способность к катодному осаждению. То есть металлы могут образовываться на поверхности катода при прохождении тока через электролит. Кроме того, металлы, проходящие электролиз, могут подвергаться окислительно-восстановительным реакциям.
В каких областях применяются свойства металлов при электролизе?
Свойства металлов при электролизе находят применение в различных областях. Например, электролиз используется в металлургии для получения металлов из их руд, а также для очистки металлов от примесей. Кроме того, электролиз применяется в гальванотехнике для нанесения металлических покрытий на различные поверхности, а также в процессе электрохимического синтеза различных соединений.
