Металлы, неметаллы и переходные металлы – это три основных класса элементов, которые имеют различные химические свойства. Металлы, такие как железо, медь и алюминий, обладают высокой электропроводностью, благодаря свободно движущимся электронам в их структуре. Они также обычно имеют блестящую поверхность, хорошую теплопроводность и высокую плотность.
Неметаллы, например, углерод, кислород и сера, отличаются от металлов по своим свойствам. Они обычно не обладают электропроводностью и могут быть хрупкими. Неметаллы часто образуют ковалентные связи, в которых электроны между атомами разделяются.
Переходные металлы являются промежуточной группой между металлами и неметаллами. Они имеют разнообразные свойства и могут образовывать стабильные и разнообразные соединения. Азот, являющийся переходным металлом, имеет широкий спектр химических свойств.
Азот является неметаллом с атомным номером 7 и молекулярной формулой N2. Он часто образует двойную ковалентную связь, чтобы достичь стабильности. Азот обладает высокой аффинностью к электронам, что делает его хорошим окислителем. Однако азот также может проявлять свойства инертности в определенных реакциях.
Химические свойства металлов

Металлы обладают рядом химических свойств, которые отличают их от неметаллов. Одна из основных характеристик металлов - способность образовывать положительные ионы (катионы) за счет отдачи одного или нескольких электронов. Это свойство называется металлической проводимостью.
Другим характерным свойством металлов является способность образовывать сплавы. Сплавы представляют собой смеси двух или более различных металлов, которые имеют новые химические и физические свойства. С помощью сплавов, металлы могут быть укреплены, сделаны более прочными и устойчивыми к коррозии.
Коррозия является одним из важных химических свойств металлов. Металлы, особенно железо, подвержены коррозии, когда они вступают в реакцию с окружающей средой, такой как вода или воздух. Это может привести к образованию окиси металла, которая обычно является нежелательным явлением, так как она может разрушать металл.
Металлы также способны образовывать соли, которые представляют собой соединения металла с кислотой. Соли металлов широко используются в промышленности и быту, например, для приготовления пищи или в процессе охлаждения и отопления.
Таким образом, химические свойства металлов включают металлическую проводимость, способность образовывать сплавы и соли, а также склонность к коррозии. Эти свойства делают металлы важными и необходимыми материалами во многих отраслях промышленности и повседневной жизни.
Окисление металлов

Окисление металлов – химический процесс взаимодействия металлов с кислородом или другими химическими веществами, в результате которого происходит образование оксидов. Этот процесс характерен для большинства металлов и является одной из основных причин их коррозии.
Когда металл находится в контакте с кислородом, происходит постепенное окисление, то есть его поверхность покрывается оксидной пленкой. Такая пленка служит защитной оболочкой для металла, предохраняет его от дальнейшего окисления и коррозии.
Процесс окисления металлов может быть стимулирован различными факторами, такими как высокая температура, влажность, наличие агрессивных веществ, окружающий воздух и т.д. В результате окисления металл может изменить свои свойства, например, цвет и структуру поверхности, что может быть использовано в промышленности для получения декоративных покрытий.
Окисление металлов может протекать разными способами и иметь важное значение не только для промышленности, но и для жизнедеятельности организмов. Важно учитывать этот процесс при разработке материалов и технологий, чтобы обеспечить их долговечность и стабильность в различных условиях эксплуатации.
Металлы как катализаторы

Металлы широко применяются в химической индустрии в качестве катализаторов. Катализаторы - вещества, которые ускоряют химическую реакцию, но при этом не расходуются и не изменяются. Они способны снижать энергию активации реакции, что позволяет увеличить скорость протекания процесса.
Металлы обладают высокой активностью в качестве катализаторов благодаря своей электрохимической активности. Они обладают свободными электронами, которые могут участвовать в реакциях с молекулами других веществ. Это позволяет им образовывать промежуточные соединения с реагентами, участвующими в реакции.
Металлы могут быть использованы в различных типах каталитических процессов, таких как гетерогенная и гомогенная катализ. В гетерогенной катализе металлы представлены в различных формах - порошок, фольга, спрессованный пористый материал и т.д. Они образуют поверхность, на которую адсорбируются реагирующие молекулы. Далее происходит реакция с участием связанных с металлом электронов.
Металлы также могут быть использованы в гомогенной катализе, когда они находятся в растворе и взаимодействуют с реагентами напрямую с помощью координационных связей. В таких системах металлы образуют сложные соединения с другими веществами и, благодаря своим химическим свойствам, способны ускорять реакции.
Металлы, в том числе переходные металлы, играют важную роль в катализе многих промышленных процессов, таких как производство аммиака, водорода, полимеров и других химических соединений. Изучение химических свойств металлов и их использование в качестве катализаторов позволяет разрабатывать новые методы синтеза различных веществ и улучшать производственные процессы.
Металлы и их реакция с кислородом
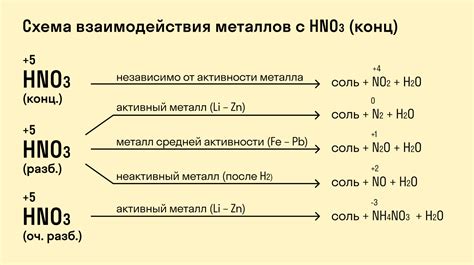
Металлы - это элементы, которые обладают высокой электропроводностью и металлическим блеском. Когда металлы вступают в контакт с кислородом, они могут реагировать и образовывать оксиды.
Реакция металлов с кислородом может происходить по-разному в зависимости от их свойств и активности. Некоторые металлы, такие как золото и платина, не реагируют с кислородом при обычных условиях. Однако большинство металлов, таких как железо и алюминий, способны реагировать с кислородом.
В результате реакции с кислородом металлы образуют оксиды. Оксиды металлов могут иметь различный характер, например, они могут быть основными или амфотерными. В основных оксидах металлы выступают в роли оснований и могут реагировать с кислотами, образуя соли и воду. В то же время амфотерные оксиды могут реагировать и с кислотами, и с щелочами.
Реакция металлов с кислородом имеет большую практическую значимость. Например, при окислении металлов они могут образовывать нежелательные оксидные пленки, что приводит к коррозии металла. Однако реакция с кислородом также может использоваться в промышленности, например, при производстве стали, где железо реагирует с кислородом, образуя оксиды, которые затем используются для получения железа и стали.
Неметаллы и их особенности

Неметаллы – это элементы, которые обладают такими свойствами, как низкая электропроводность, отсутствие металлического блеска, хрупкость и способность образовывать ковалентные связи с другими атомами. Они часто характеризуются высокой электроотрицательностью и являются хорошими окислителями.
Неметаллы имеют разнообразные применения в нашей жизни. Например, кислород является одним из основных компонентов воздуха и необходим для дыхания. Азот используется в производстве удобрений и взрывчатых веществ. Водород является основным источником энергии в ядерных реакциях и используется в производстве различных химических веществ.
Некоторые неметаллы, например, флуор и хлор, добавляются в питьевую воду для дезинфекции. Бром используется в производстве пластиков и огнезащитных материалов. Фосфор используется в производстве удобрений и бытовой химии. Селен и теллур – полупроводники, которые находят широкое применение в электронике и солнечных батареях.
Некоторые неметаллы образуют взрывоопасные смеси или являются ядовитыми. Например, хлор, фосфор и фтор в больших концентрациях могут быть опасными для человека и окружающей среды. Однако, неметаллы играют важную роль в химической промышленности и нашей повседневной жизни.
Реакция неметаллов с металлами
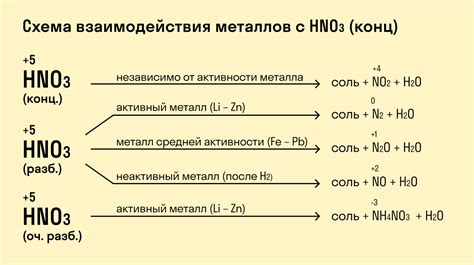
Реакция неметаллов с металлами представляет собой химический процесс, в результате которого происходит образование новых веществ. Неметаллы и металлы обладают разными химическими свойствами, поэтому их взаимодействие может происходить по-разному.
При взаимодействии неметаллов с металлами могут возникать различные реакции, такие как прямое синтезирование, диспропорционирование или образование кислот. Например, реакция азота с металлами может приводить к образованию нитридов или амидов.
Реакция неметаллов с металлами может быть эндотермической или экзотермической, то есть сопровождаться поглощением или выделением тепла. Например, при реакции хлора с металлами, такими как натрий или калий, происходит интенсивное выделение тепла и возгорание.
Реакция неметаллов с металлами играет важную роль в промышленности и науке. Эти реакции могут использоваться для получения новых материалов, производства электролитов, создания новых соединений и т.д. Изучение химических свойств неметаллов и их взаимодействия с металлами является одной из основ химии и материаловедения.
Вопрос-ответ

Каковы химические свойства азота?
Азот - это неметалл, химический элемент с атомным номером 7 в периодической системе элементов. У азота есть несколько основных химических свойств: он очень реактивен и образует соединения с различными элементами, в основном с кислородом, водородом и металлами. Азот также может образовывать множество различных соединений, включая аммиак, многочисленные оксиды и азиды. Азот имеет низкую температуру кипения и является главным компонентом воздуха.
Какова роль азота в природе и в живых организмах?
Азот играет важную роль в природе и в живых организмах. Он является необходимым питательным элементом для растений, так как входит в состав аминокислот, белков и нуклеиновых кислот. Растения получают азот из почвы и воздуха. Азот также является ключевым компонентом биохимических процессов в живых организмах, таких как синтез протеинов и ДНК. Кроме того, азот играет важную роль в экологических циклах, таких как азотный цикл, где азот перерабатывается в различные формы и циркулирует в природной среде.
Какие соединения образует азот?
Азот образует множество соединений с другими элементами. Некоторые из них включают аммиак (NH3), который является основным источником азота для растений и используется в производстве удобрений. Азот также образует оксиды азота (NOx), которые играют важную роль в атмосферных реакциях и являются причиной загрязнения воздуха. Кроме того, азот может образовывать азиды, такие как натриевый азид (NaN3), который широко используется в автомобильных подушках безопасности.
