Металлы обладают рядом уникальных свойств, которые делают их особо ценными и необходимыми в различных сферах жизни. Одним из важных аспектов их свойств является их взаимодействие с простыми веществами - водой, кислородом, серой и т.д. На этот процесс могут оказывать влияние различные факторы, такие как температура, давление и концентрация веществ, а также структура и химический состав металла.
Вода является одной из важнейших сред для жизни на Земле, однако она может взаимодействовать с металлами, вызывая различные процессы. Некоторые металлы, такие как натрий и калий, реагируют с водой, образуя щелочные гидроксиды и выделяя водород. Другие металлы, такие как железо и алюминий, могут образовывать оксиды, которые образуют защитную пленку на поверхности металла и предотвращают дальнейшее взаимодействие с водой.
Кислород – еще одно простое вещество, с которым металлы могут вступать в реакцию. Окисление металлов под воздействием кислорода приводит к образованию оксидов, таких как оксид железа (ржавчина) или оксид алюминия. Некоторые металлы, такие как золото и платина, не реагируют с кислородом при обычных условиях, благодаря своей химической инертности.
Сера – еще одно простое вещество, которое может взаимодействовать с металлами. Некоторые металлы, такие как цинк и свинец, реагируют с серой, образуя соединения, которые могут иметь различные цвета и свойства. Взаимодействие металлов с серой может также привести к коррозии, особенно в присутствии влаги и кислорода.
Итак, свойства металлов при взаимодействии с простыми веществами определяют их химическую реакционную способность и могут приводить как к полезным, так и к нежелательным результатам. Изучение этих свойств позволяет понять процессы, происходящие с металлами в различных условиях и на их основе создавать новые материалы и технологии.
Металлы и их химические свойства

Металлы – это классические элементы химической периодической системы, обладающие рядом характерных свойств. Одной из основных характеристик металлов является их способность образовывать катионы, то есть положительно заряженные ионы. Эта способность обусловлена низкой электроотрицательностью металлов, что обеспечивает им способность отдавать электроны при взаимодействии с другими веществами.
Металлы также обладают высокой тепло- и электропроводностью. Это связано с особенностями строения ионной решетки металлического кристалла, которая позволяет электронам свободно двигаться по металлу. Благодаря этим свойствам, металлы широко применяются в различных отраслях промышленности, например, для создания проводов и электродов.
Еще одним важным свойством металлов является их способность реагировать с различными простыми и сложными веществами. Металлы обычно образуют соединения с кислородом, образуя оксиды. Некоторые металлы также образуют соединения с неокисными элементами. Например, реакция железа с серой приводит к образованию сульфида железа.
Важно отметить, что разные металлы могут проявлять разные свойства при взаимодействии с простыми веществами. Например, некоторые металлы образуют стабильные соединения с водой, в то время как другие металлы могут реагировать с водой, выбросив при этом водородный газ. Эти различия в свойствах металлов важны при выборе материалов для различных технических и промышленных целей.
Свойства металлов при взаимодействии с кислородом
Реакция металлов с кислородом
Металлы проявляют различные свойства при взаимодействии с кислородом. Некоторые металлы, такие как железо и алюминий, реагируют с кислородом воздуха, образуя оксиды. Ржавчина на поверхности железа и оксидная пленка на алюминии являются результатом таких реакций.
Коррозия металлов
Коррозия – это процесс, при котором металлы вступают в реакцию с кислородом и другими веществами в своем окружении, что приводит к разрушению их структуры. Коррозия металлов является основной причиной их повреждения и потери своих свойств.
Пассивация металлов
Некоторые металлы, например, алюминий и нержавеющая сталь, обладают способностью образовывать защитные пленки, которые способны сопротивляться дальнейшему воздействию кислорода и других веществ. Это свойство называется пассивацией и является одним из основных преимуществ этих металлов.
Защитные покрытия
Чтобы предотвратить коррозию металлов при взаимодействии с кислородом, часто используются защитные покрытия, такие как краска, лаки и гальваническое покрытие. Эти покрытия создают защитный барьер между металлом и окружающей средой, предотвращая проникновение кислорода и других вредных веществ.
Огнестойкость металлов
Некоторые металлы, включая алюминий и магний, обладают высокой огнестойкостью благодаря своему химическому составу и способности образовывать защитные оксидные пленки при взаимодействии с кислородом. Это делает их незаменимыми материалами в строительстве и других отраслях, где требуется высокая огнестойкость.
Металлы в реакции с водой

Реакция металлов с водой является одним из основных свойств металлов при их взаимодействии с простыми веществами. В результате этой реакции металлы образуют гидроксиды металлов и выделяются газы.
Некоторые металлы, такие как натрий, калий и литий, очень активно реагируют с водой. При этом они непосредственно контактируют с водой, образуется щелочь и выделяется водородный газ.
Другие металлы, такие как железо или алюминий, реагируют с водой, но в этом случае реакция происходит медленнее и требует участия кислорода.
Существуют также металлы, которые не реагируют с водой, например, золото и платина, они нереактивны с водой даже при нагревании.
Реакция металлов с водой может служить для выделения металлов из руд и для получения водорода.
Таблица ниже показывает некоторые металлы и их поведение в реакции с водой:
| Металл | Реакция с водой |
|---|---|
| Натрий | Сильно реагирует, выделяется водородный газ |
| Железо | Медленно реагирует, требуется наличие кислорода |
| Алюминий | Реагирует с выделением водородного газа |
| Золото | Не реагирует с водой |
Металлы и их взаимодействие с кислотами
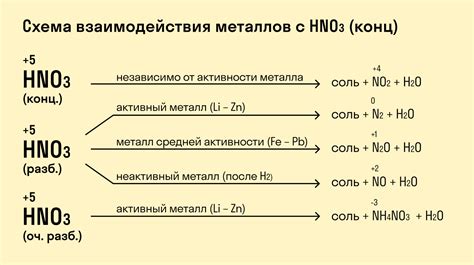
Металлы имеют уникальные свойства, которые позволяют им взаимодействовать с различными веществами, включая кислоты. В результате такого взаимодействия металлы могут проявлять как положительные, так и отрицательные свойства.
Когда металлы взаимодействуют с кислотами, происходит процесс, называемый окислением металла. В этом процессе металл отдает электроны кислоте, что позволяет кислоте проявить свои химические свойства. При этом металл может либо полностью раствориться в кислоте, образуя ион, либо образовать окисленное соединение.
Некоторые металлы, такие как литий, натрий и калий, очень реакционны и могут растворяться в кислотах даже при комнатной температуре. Например, литий реагирует с водой, образуя литий-гидроксид и выделяя гидроген. Кроме того, металлы, такие как железо, алюминий и цинк, могут полностью растворяться в различных кислотах, образуя ионы металла и водород.
Взаимодействие металлов с кислотами может также возникать в результате неконтролируемого процесса, называемого коррозией металла. Когда металлы окисляются в присутствии кислорода и воды, происходит химическая реакция, которая приводит к образованию кислотного оксида на поверхности металла. Это может привести к разрушению металла и повреждению его структуры.
Таким образом, взаимодействие металлов с кислотами имеет большое значение в различных областях, включая химию, материаловедение и инженерию. Понимание таких взаимодействий позволяет улучшать процессы производства, разрабатывать новые материалы и создавать инновационные технологии.
Взаимодействие металлов с щелочами и щелочноземельными металлами

Взаимодействие металлов с щелочами и щелочноземельными металлами представляет собой одну из основных реакций, происходящих между элементами и веществами в химических процессах. Эти реакции характеризуются образованием ионных соединений и проявляются в выделении газов, тепла и изменении цвета реагирующих веществ.
Металлы, как правило, обладают активными ионами, способными вступать в реакцию с щелочами и щелочноземельными металлами. При этом образуется соль и выделяется молекулярный водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия (NaOH) и выделению водорода (H2).
Взаимодействие металлов с щелочами и щелочноземельными металлами может представляться в виде химических уравнений. Например, взаимодействие магния с гидроксидом натрия (NaOH) приводит к образованию гидроксида магния (Mg(OH)2) и выделению молекулярного водорода (H2).
Также взаимодействие металлов с щелочами и щелочноземельными металлами может происходить в форме двойного обмена, при котором ионы одного металла обмениваются с ионами другого металла. Например, реакция алюминия с гидроксидом калия (KOH) приводит к образованию гидроксида алюминия (Al(OH)3) и соли калия (KAl(OH)4).
Металлы и их реакция с галогенами

Галогены – это элементы главной подгруппы VII периодической системы. К ним относятся фтор (F), хлор (Cl), бром (Br) и йод (I). Галогены являются сильными окислителями и образуют постепенно возрастающие температурой соединения с многими металлами.
Реакция металлов с галогенами приводит к образованию хлоридов, бромидов или иодидов, в зависимости от того, какой галоген используется. Многие металлы могут быть облегчены различными галогенами, однако различные металлы образуют соединения с разными галогенами с разной интенсивностью и скоростью.
Например, натрий (Na) реагирует с фтором (F) или хлором (Cl), образуя соответствующие соли – фторид натрия (NaF) и хлорид натрия (NaCl). Однако реакция натрия с фтором протекает значительно более интенсивно и энергично по сравнению с реакцией натрия с хлором.
Многие металлы, включая алюминий (Al) и железо (Fe), реагируют с галогенами, образуя соответствующие соли. Некоторые металлы, такие как железо, образуют разные соединения с разными галогенами, что позволяет использовать эти реакции для получения различных химических веществ.
Реакция металлов с галогенами может также происходить в растворе, образуя ионные соединения. Например, раствор галогена в воде может реагировать с металлом, образуя ионометаллические соединения. Эти реакции широко используются в химической промышленности и лабораторных исследованиях для получения различных химических соединений и солей.
Влияние температуры на свойства металлов при взаимодействии с простыми веществами

Температура играет важную роль во взаимодействии металлов с простыми веществами. При повышении температуры обычно увеличивается скорость химических реакций, в том числе и реакций металлов с простыми веществами. Некоторые металлы, такие как железо и алюминий, при нагревании сильно окисляются, образуя оксиды или гидроксиды. Такие окислительные реакции могут протекать еще быстрее при повышенных температурах.
Повышение температуры может также вызывать изменение физических свойств металлов. Например, многие металлы при нагревании расширяются. Это свойство может быть использовано в различных промышленных процессах, например, для монтажа элементов конструкций или для производства термометров. Также, некоторые металлы при нагревании меняют свою структуру и становятся более мягкими и пластичными, что может быть полезным в технологии обработки металлов.
Однако высокая температура может также способствовать разрушению металлов. При нагревании металлы могут подвергаться окислению, коррозии или даже плавлению. Это имеет большое значение при выборе материалов для работы в экстремальных условиях, например, в авиации или при производстве электрических приборов.
Таким образом, температура является важным фактором во взаимодействии металлов с простыми веществами. Она может влиять как на химическую активность металлов, так и на их физические свойства. Изучение и понимание этих свойств помогают разрабатывать новые материалы и улучшать технологии обработки металлов.
Вопрос-ответ

Какие свойства металлов проявляются при взаимодействии с кислородом?
Металлы активно реагируют с кислородом и образуют оксиды. Эта реакция называется окислением. При этом металлы могут образовывать разные оксиды в зависимости от своей степени окисления. Например, натрий образует оксид натрия (Na2O), а алюминий – оксид алюминия (Al2O3).
Какое влияние оказывает взаимодействие металлов с галогенами?
Взаимодействие металлов с галогенами (хлором, фтором, бромом, йодом) приводит к образованию солей. Обычно металлы отдают свои электроны галогенам, образуя положительно заряженные ионы (катионы), а галогены получают эти электроны, становятся отрицательно заряженными и образуют анионы. Такие ионы притягиваются друг к другу и образуют соли.
Какие свойства металлов проявляются при взаимодействии с кислотами?
Металлы активно реагируют с кислотами и образуют соли и водород. При этом металлы отдают свои электроны кислотам, образуя положительно заряженные ионы (катионы), а водород образует воду. Образовавшиеся соли могут быть разной природы и в зависимости от кислоты и металла, например, хлорид натрия (NaCl), сульфат магния (MgSO4) и т.д.
