Кислоты – это химические соединения, обладающие специфическими свойствами и способными проявляться взаимодействием с различными веществами. Кислоты могут быть органическими и неорганическими и иметь разные степени кислотности. Одной из важнейших особенностей кислот является их способность образовывать ионные растворы, в которой положительно или отрицательно заряженные ионы свободно перемещаются в растворе.
Кислоты часто взаимодействуют с металлами, что приводит к образованию солей и выделению водорода. Взаимодействие кислот и металлов имеет большое практическое значение и находит применение в различных сферах науки и промышленности. Оно определяется специфическими химическими свойствами как кислот, так и металлов.
Механизмы взаимодействия кислот и металлов могут быть различными, но основной процесс состоит в том, что металл подвергается окислению, отдавая электроны. Кислота, в свою очередь, принимает эти электроны, восстанавливаясь. Результатом взаимодействия кислоты с металлами является образование солей и выделение водорода.
Основные свойства кислот

Кислоты - это химические соединения, обладающие специфическими свойствами, такими как кислотность, реактивность и способность взаимодействовать с металлами. Они широко используются в промышленности, медицине и повседневной жизни.
Одним из основных свойств кислот является их кислотность. Кислотные соединения обладают способностью давать ион водорода (H+) в растворах. Именно это свойство обуславливает их способность растворять металлы, образовывая соли и выделяя водородный газ.
Важным свойством кислот является их реактивность. Кислоты активно взаимодействуют с различными соединениями, образуя новые вещества. Например, они могут растворять оксиды металлов, образуя соли, или реагировать с щелочами, образуя соли и воду.
Еще одним важным свойством кислот является их коррозионная активность. Многие кислоты обладают способностью разрушать металлы, вызывая коррозию. Это связано с их способностью обмена ионами с металлической поверхностью, что приводит к ее разрушению.
Взаимодействие кислот с металлами имеет важное техническое значение. Например, соляная кислота используется для очистки поверхности металлов перед нанесением покрытий, а серная кислота применяется в процессе гальванического покрытия металлов.
Кислотность и основность
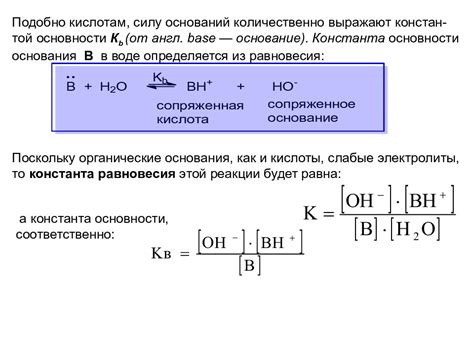
Кислотность и основность являются основными характеристиками химических веществ, определяющими их свойства и взаимодействие с другими веществами. Кислоты - это вещества, способные отдавать протоны или протонировать другие вещества. Основания, напротив, принимают протоны или депротонируют другие вещества.
Одной из основных особенностей кислот является их способность реагировать с металлами. Кислоты могут образовывать соли и выделять водород при взаимодействии с металлами. В зависимости от своей активности, кислоты могут реагировать с разными металлами по-разному. Некоторые кислоты, такие как соляная кислота, обладают достаточно высокой активностью и могут растворять множество металлов, выделяя водород и образуя соли. Другие кислоты, например, азотная кислота, могут реагировать только с определенными металлами, образуя специфические соли.
Основные свойства оснований связаны с их способностью принимать протоны. Основания часто используются в химических реакциях для нейтрализации кислот. При взаимодействии оснований с кислотами образуются соли и вода. Важным свойством оснований является их степень основности. Ее можно определить с помощью pH-шкалы, где значения более 7 указывают на основность. Различные основания могут иметь различную степень основности и проявлять различные свойства при взаимодействии с кислотами.
Строение молекул кислот

Молекулы кислот состоят из атомов, объединенных связями, и имеют определенную трехмерную структуру. Внутри молекулы кислоты присутствуют функциональные группы, которые обеспечивают ее кислотные свойства.
Основной функциональной группой кислоты является карбонильная группа, содержащая атом кислорода, связанный с атомом углерода двойной связью. При этом на углеродном атоме карбонильной группы может находиться различные заместители, такие как атомы водорода или другие органические группы.
Кроме карбонильной группы, в молекулах кислоты могут присутствовать и другие функциональные группы, такие как карбоксильная или сульфогруппа. Карбоксильная группа состоит из карбонильной группы и гидроксильной группы, связанных с одним атомом углерода.
Структура молекул кислот может быть линейной, циклической или ветвистой. Линейные молекулы кислот образуют прямую цепь из атомов углерода, связанных друг с другом. Циклические молекулы кислот образуют кольцевую структуру, в которой атомы углерода объединены в замкнутом кольце.
Взаимодействие молекул кислот с металлами осуществляется посредством образования координационных соединений. Металлы образуют с кислотами сильные связи, атом металла связывается с карбоксильной или другой функциональной группой кислоты.
Формулы и названия кислот

Кислоты - это химические соединения, обладающие свойствами алкалий и способные образовывать ион H+. Формула кислоты состоит из символов, обозначающих элементы, и цифр, показывающих количество атомов каждого элемента.
Названия кислот обычно состоят из двух частей: названия иона, который образует кислоту, и слова "кислота". Например, HClO4 - перхлоровая кислота, H2SO4 - серная кислота, HNO3 - азотная кислота. Иногда кислоту можно назвать по названию основания, с которым она образует соль. Например, HCl - соляная кислота, H3PO4 - фосфорная кислота.
Кислоты могут быть одноосновными, состоящими из одного иона, или многоосновными, состоящими из нескольких ионов. Одноосновные кислоты имеют простые формулы, например, HCl - соляная кислота. Многоосновные кислоты имеют сложные формулы, такие как H3PO4 - фосфорная кислота.
Существует множество различных кислот, каждая из которых имеет свои уникальные свойства и формулы. Изучение формул и названий кислот помогает понять их свойства и использование в различных химических реакциях.
Кислотные реакции

Кислоты - вещества, которые обладают кислотными свойствами. Они могут реагировать с различными веществами, включая металлы, образуя соли и выделяя водород. Кислотные реакции основываются на принципе обмена ионами и являются одной из основных категорий химических реакций.
Взаимодействие кислот с металлами приводит к образованию солей и выделению водорода. Водород выделяется в виде пузырьков газа. Эти реакции обычно очень энергичные и сопровождаются сильным разогревом.
Реактивность кислот зависит от их концентрации и свойств металла, с которым они взаимодействуют. Чем выше концентрация кислоты, тем более интенсивная будет реакция. Аналогично, более активные металлы будут реагировать с кислотами сильнее и быстрее.
Кислотные реакции могут протекать спонтанно, например, реакция соляной кислоты с цинком, или быть индуцированными, как реакция соляной кислоты с медью в присутствии платины. В зависимости от условий, можно изменить скорость реакции и управлять процессом.
Таким образом, кислотные реакции с металлами представляют собой важный класс реакций, которые используются в различных областях, включая промышленность и лабораторные исследования.
Окислительно-восстановительные свойства кислот

Кислоты – это вещества, способные выступать в качестве окислителей или восстановителей в химических реакциях. Это связано с их способностью принимать или отдавать электроны при взаимодействии с другими веществами.
Кислоты обладают окислительными свойствами, когда они способны вступать в реакции окисления других веществ. В процессе окисления кислота принимает электроны от вещества, которое окисляется. Сама кислота при этом восстанавливается, т.е. отдаёт электроны. Примером является реакция кислорода с водородом в присутствии катализатора:
2H2 + O2 → 2H2O
В этой реакции кислород выступает в роли окислителя, а водород – в роли восстановителя.
Кроме того, кислоты могут проявлять восстановительные свойства, когда они способны отдавать электроны другим веществам, участвующим в окислительных реакциях. В таком случае кислота сама окисляется и теряет электроны. Например, серная кислота (H2SO4) может восстанавливать неметаллы:
| Вещество | Реакция |
|---|---|
| Серная кислота | H2SO4 + 2H+ + 2e- → SO2 + 2H2O |
| Хлор | Cl2 + 2e- → 2Cl- |
В данной реакции серная кислота восстанавливается, отдавая электроны хлору.
Таким образом, окислительно-восстановительные свойства кислот проявляются при их участии в реакциях окисления и восстановления, в которых они могут выступать в роли окислителей или восстановителей в зависимости от условий реакции и своей химической активности.
Понятие концентрации кислот

Концентрация кислоты является важной характеристикой, определяющей количество диссоциированных ионов кислоты в растворе. Концентрация кислоты может быть выражена в разных единицах, таких как молярность, мольная доля или процентное содержание.
Молярность выражает количество молей кислоты, растворенной в 1 литре раствора. Данная величина позволяет определить степень диссоциации кислоты и ее активность в растворе. Молярность можно рассчитать по формуле: C = n/V, где C – молярность кислоты, n – количество молей кислоты, V – объем раствора.
Мольная доля выражает отношение массы кислоты к массе раствора. Мольная доля позволяет определить процентное содержание кислоты в растворе. Мольную долю можно рассчитать по формуле: X = m/M, где X – мольная доля кислоты, m – масса кислоты, M – масса раствора.
Процентное содержание кислоты определяет количество граммов кислоты в 100 граммах раствора. Данная величина обычно выражается в процентах и позволяет быстро оценить концентрацию кислоты в растворе. Процентное содержание кислоты можно рассчитать по формуле: % = (m/M) * 100%, где % – процентное содержание кислоты, m – масса кислоты, M – масса раствора.
Знание концентрации кислоты позволяет определить ее силу и прогнозировать ее взаимодействие с металлами. Выбор оптимальной концентрации кислоты играет важную роль в различных химических процессах и технологиях.
Влияние кислот на органические соединения
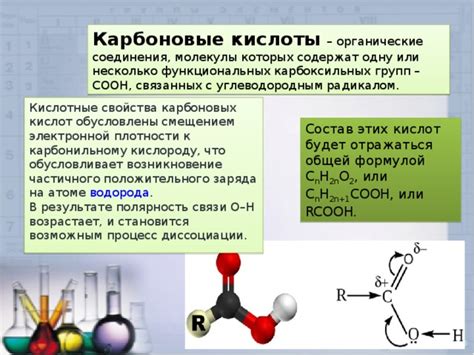
Органические соединения, такие как углеводороды, алкены и алканы, могут быть подвержены воздействию кислот, что приводит к различным химическим реакциям и изменению своих свойств.
Одним из наиболее распространенных взаимодействий органических соединений с кислотами является образование добавочных соединений. Например, алкены могут реагировать с кислотами, образуя аддуки – соединения, в которых существует связь между одним из атомов углерода алкена и одной из кислородных (или других) атомов кислоты.
Кроме того, кислоты могут приводить к окислению органических соединений. Например, алканы и алкены могут взаимодействовать с кислородом, что приводит к образованию соответствующих карбоновых кислот. Данный процесс может сопровождаться образованием окислителей, восстановителей и промежуточных продуктов.
Также взаимодействие органических соединений с кислотами может вызвать изменение их растворимости. Например, растворимость алканов может увеличиваться при взаимодействии с кислотами, тогда как растворимость некоторых алкенов может уменьшаться.
Однако, влияние кислот на органические соединения может быть различным и зависит от многих факторов, таких как концентрация кислоты, структура органического соединения, условия реакции и др. Поэтому важно учитывать все эти факторы при изучении взаимодействия кислот с органическими соединениями.
Взаимодействие кислот с металлами
Взаимодействие кислот с металлами является одним из основных процессов в химии. Кислоты обладают способностью расщепляться на ионы водорода (H+) и анионы. Когда металл вступает в контакт с кислотой, происходит замещение водорода атомом металла.
Взаимодействие кислоты с металлом протекает с образованием соли и выделением водорода в виде газа или растворенного в воде. При этом наблюдается химическая реакция, сопровождающаяся выделением тепла и образованием новых веществ.
Реактивность металлов взаимодействовать с кислотами зависит от их электрохимического потенциала. Как правило, активные металлы, такие как натрий и калий, быстро реагируют с кислотами, выделяя большое количество водорода. Менее активные металлы, такие как железо и медь, реагируют медленнее и не так интенсивно.
Взаимодействие кислоты с металлами может протекать по различным механизмам. Например, взаимодействие сильной кислоты с активным металлом может привести к самовоспламенению реакционной смеси. Также возможно образование осадка при взаимодействии кислоты и металла, что часто наблюдается при реакции с более пассивными металлами.
Контролировать взаимодействие кислоты с металлами важно для безопасности и эффективности проведения химических реакций. Изучение данной темы позволяет предсказывать ход реакции и выбирать подходящие условия, а также понимать свойства различных металлов и кислот.
Вопрос-ответ

Каковы основные свойства кислот?
Основные свойства кислот – это кислотность, реакция с металлами и неорганическими веществами, способность вытеснять другие кислоты из их солей.
Как происходит взаимодействие кислот с металлами?
Взаимодействие кислот с металлами происходит с образованием солей и выделением водорода. При этом происходит реакция, в результате которой металл замещается водородом в кислоте, образуя соль металла и выделяя водородный газ.
Каковы особенности свойств кислотной среды?
Основные особенности свойств кислотной среды - это наличие кислотности, то есть способность кислоты отдавать протоны, а также ее реакция с металлами и образование солей.
Какие химические реакции могут происходить между кислотами и металлами?
Между кислотами и металлами могут происходить различные химические реакции, включая реакцию замещения, где металл замещает водород в кислоте, образуя соль металла и выделяя водородный газ.
Какие соединения образуются при взаимодействии кислот с металлами?
При взаимодействии кислот с металлами образуются соли металлов. Например, при взаимодействии серной кислоты с цинком образуется цинксульфат, а водород выделяется в виде газа.
