Реактивность йода с другими металлами является одним из важных аспектов химических реакций. Йод – химический элемент из группы галогенов, который широко используется в различных отраслях промышленности и лабораторной практике. Одним из направлений исследований в химии является изучение взаимодействия йода с разными металлами, таких как натрий, калий, алюминий и др.
Взаимодействие йода с металлами может протекать по разным механизмам, включая замещение, окисление и восстановление. При замещении йодом другого металла происходит образование соответствующего йодида металла, при этом йод выделяется в виде пара или растворяется в воде. Однако, реакция с каждым металлом может иметь свои особенности и проходить по определенному химическому пути.
Например, взаимодействие йода с металлом натрия приводит к образованию йодида натрия. Реакция происходит с выделением тепла и образованием коричневой пары йода. Эта реакция является качественной реакцией на ион натрия и йодид и широко используется в аналитической химии для обнаружения наличия иона натрия в различных образцах.
Реактивность йода в реакциях с металлами
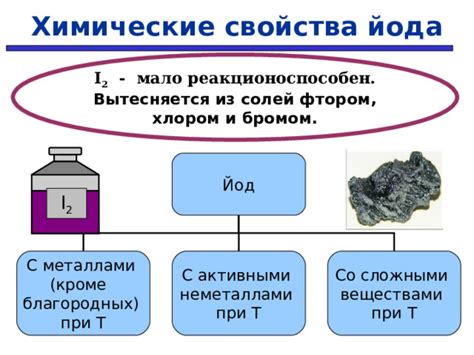
Йод – химический элемент, относящийся к галогенам. Он встречается в природе в виде минерала йодаргирита или в растворенном состоянии в океанах и морях. Реактивность йода зависит от температуры, давления, концентрации, растворителя, а также от свойств самого металла.
Реакция йода с металлами может происходить различными способами. Например, некоторые металлы могут образовывать соединения с йодом при нагревании. В таких реакциях металл уступает свои электроны йоду, образуя ион металла и йодид. Этот процесс называется окислением металла и восстановлением йода.
Другие металлы проявляют реакцию с йодом уже при комнатной температуре. Степень реакции зависит от активности металла. Например, цинк активно реагирует с йодом, образуя йодид цинка. Реакция также сопровождается выделением энергии в виде тепла и света.
Реактивность йода с металлами можно классифицировать по возрастанию активности металлов. Самыми реактивными металлами в реакции с йодом являются щелочные металлы, такие как литий, натрий и калий. Они образуют ионы щелочного металла и йодида, сопровождаясь ярким голубым огнем.
Взаимодействие йода с щелочными металлами
Щелочные металлы, такие как литий, натрий, калий и рубидий, могут реагировать с йодом, образуя йодиды металлов. Эта реакция является типичной для данной группы элементов, так как они обладают высокой активностью и легко участвуют в химических реакциях.
Реакция взаимодействия йода с щелочными металлами происходит при нагревании. При этом, йод превращается в пары и осуществляет выход из системы в виде фиолетового газа. В результате образуются соответствующие йодиды металлов, которые часто имеют характерные цвета. Например, йодид лития имеет цвет красного вина, а йодид натрия – ярко-желтый.
Данная реакция может быть представлена с помощью следующего уравнения:
| 2 Li + I2 | → | 2 LiI |
Таким образом, реакция между щелочными металлами и йодом представляет собой пример окислительно-восстановительной реакции, где металл окисляется, а йод восстанавливается.
Это взаимодействие имеет практическое применение, так как йодиды металлов могут использоваться в медицине, в качестве источников йода. Например, йодид калия широко применяется для профилактики йодного недостатка и лечения заболеваний щитовидной железы. Также щелочные металлы используются в различных технических процессах и производстве различных химических соединений.
Реакции йода с щелочноземельными металлами
Щелочноземельные металлы химически активны и могут образовывать соединения с различными веществами, включая йод. Реакция йода с этими металлами протекает с образованием йодидов, обладающих специфическими свойствами.
Например, реакция йода с магнием приводит к образованию йодида магния (MgI2). Это белый кристаллический порошок, который хорошо растворяется в воде. Йодид магния обладает антисептическими свойствами и может использоваться в медицине.
Реакция йода с кальцием приводит к образованию йодида кальция (CaI2). Это белые кристаллы, растворимые в воде. Йодид кальция часто используется в фармацевтической и пищевой промышленности в качестве пищевой добавки.
Реакция йода с стронцием приводит к образованию йодида стронция (SrI2). Этот соединение обладает хорошей растворимостью в воде и может использоваться в качестве источника стронция в различных применениях, например, в производстве фотографических материалов.
Таким образом, реакции йода с щелочноземельными металлами приводят к образованию соединений, которые могут применяться в различных отраслях промышленности и медицине.
Реакции йода с переходными металлами

Йод – химический элемент, который активно взаимодействует с различными металлами, включая переходные металлы. Переходные металлы – это элементы из блока d-периода периодической системы, которые обладают высокой реакционной способностью и разнообразными свойствами.
Реакция йода с переходными металлами включает образование йодидов. Например, реакция между йодом и медью приводит к образованию медного йодида (CuI). Данная реакция может быть использована для определения присутствия йода в образце.
Взаимодействие йода с железом приводит к образованию железного йодида (FeI2). Эта реакция может использоваться для синтеза органических соединений на основе йода.
С другой стороны, реакция йода с некоторыми переходными металлами может быть нестабильной или неполной. Например, взаимодействие йода с алюминием приводит к образованию алюминиевого йодида (AlI3), однако данная реакция проходит медленно и может быть неполной.
Таким образом, реакция йода с переходными металлами может быть использована для синтеза различных соединений, идентификации содержания йода, а также изучения взаимодействия между различными элементами.
Вопрос-ответ

Как реагирует йод с алюминием?
Реакция йода с алюминием происходит с выделением тепла и образованием соли алюминия йодида. Уравнение реакции выглядит следующим образом: 2Al + 3I2 -> 2AlI3.
Может ли йод реагировать с железом?
Йод не реагирует с железом при обычных условиях, так как железо не обладает достаточной активностью. Однако, при повышенных температурах и в присутствии катализаторов реакция йода с железом может протекать и образовывать йодид железа (FeI2) или иодид двухвалентного железа (FeI3).
Каковы основные свойства реакции йода с медью?
Реакция йода с медью происходит с образованием йодида меди (CuI) и выделением фиолетового пара йода. Уравнение реакции выглядит следующим образом: Cu + I2 -> CuI. Реакция осуществляется при нагревании и сопровождается выделением тепла.
Может ли йод взаимодействовать с оловом?
Йод не реагирует с оловом при обычных условиях, так как олов не обладает достаточной активностью. Однако, при нагревании и в присутствии катализаторов реакция йода с оловом может протекать и образовывать йодид олова (SnI2).
Что происходит при реакции йода с цинком?
Реакция йода с цинком происходит с выделением тепла и образованием соли цинка йодида. Уравнение реакции выглядит следующим образом: Zn + I2 -> ZnI2.
