Щелочноземельные металлы являются второй группой периодической таблицы элементов и включают в себя шесть химических элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они получили свое название благодаря своей реактивной природе, которая проявляется в присутствии воды и кислорода.
Важными свойствами щелочноземельных металлов являются их малая электроотрицательность и активность. Их малая электроотрицательность обусловлена более сложной структурой электронных оболочек по сравнению с щелочными металлами. Активность щелочноземельных металлов обусловлена невысоким значением энергии ионизации первого электрона, что делает их легко ионизируемыми.
Щелочноземельные металлы образуют соединения с различными элементами благодаря своим активным химическим свойствам. Одной из их основных реакций является реакция с водой, в результате которой образуется соответствующий оксид щелочноземельного металла и выделяется водород. Они также реагируют с кислородом, образуя оксиды и пероксиды, при сжигании соединений с кислородом реакция происходит очень интенсивно.
Взаимодействие щелочноземельных металлов с другими элементами приводит к образованию разнообразных соединений, которые находят широкое применение в нашей повседневной жизни, в промышленности и в медицине. Знание свойств и химических реакций этих металлов является важным для понимания их применения и возможности модификации их свойств для конкретных нужд.
Общие свойства щелочноземельных металлов

Щелочноземельные металлы - это элементы второй группы периодической таблицы, включающие бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы имеют сходные общие свойства и взаимодействуют с другими элементами похожим образом.
Первое общее свойство щелочноземельных металлов - они являются металлами. Все эти элементы обладают металлическим блеском, проводят электричество и тепло, и имеют высокую плотность. Они также мягкие и при давлении легко поддаются формированию листов и проволоки.
Второе общее свойство щелочноземельных металлов - они обладают малой электроотрицательностью. Это значит, что они имеют тенденцию отдавать свои электроны во время химических реакций. Из-за этого они образуют положительно заряженные ионы, когда вступают во взаимодействие с другими элементами.
Третье общее свойство щелочноземельных металлов - они реагируют с водой. Когда щелочноземельный металл попадает в воду, он образует щелочные растворы и выделяет водород газ. Например, магний реагирует с водой, образуя гидроксид магния (Mg(OH)2) и выделяя водород.
Четвертое общее свойство щелочноземельных металлов - они образуют соединения с кислородом. Когда щелочноземельный металл соединяется с кислородом, образуется оксид металла. Например, бериллий соединяется с кислородом, образуя оксид бериллия (BeO).
Таким образом, щелочноземельные металлы имеют ряд общих свойств, таких как металлическая природа, малая электроотрицательность, реакция с водой и образование оксидов при взаимодействии с кислородом. Эти свойства отличают щелочноземельные металлы от других групп элементов и делают их уникальными.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы - это группа элементов в периодической системе, которые организованы в группу 2, за исключением газообразного гелия. Они включают бериллий, магний, кальций, стронций, барий и радий. У этих элементов есть общие химические свойства, которые отличают их от других элементов.
Первое химическое свойство щелочноземельных металлов - их реакционная способность. Эти металлы легко вступают в реакцию с водой, кислородом и другими химическими веществами. Они образуют оксиды, гидроксиды и соли, которые часто проявляют щелочные свойства.
Еще одно химическое свойство щелочноземельных металлов - их способность образовывать ионы с положительным зарядом. Щелочноземельные металлы имеют два валентных электрона в своей внешней оболочке, и они легко отдают эти электроны, чтобы образовать положительные ионы. Это объясняет их высокое химическое активность и способность вступать в реакцию с другими элементами.
Одно из важных свойств щелочноземельных металлов - их способность растворяться в воде. Бериллий и магний плохо растворяются в холодной воде, но хорошо растворяются в кипящей воде. Остальные щелочноземельные металлы хорошо растворяются в воде.
Еще одно химическое свойство щелочноземельных металлов - их способность образовывать комплексные соединения. Они могут соединяться с различными лигандами, такими как аммиак, водород, клинокс, образуя стабильные комплексы. Это свойство используется в различных отраслях науки и промышленности.
Щелочноземельные металлы играют важную роль в химической промышленности и в нашей повседневной жизни. Они находят применение в производстве легких сплавов, пищевых добавок, лекарственных препаратов и многих других сферах.
Взаимодействие щелочноземельных металлов с кислородом

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают способностью вступать в реакцию с кислородом. Это взаимодействие происходит при нагревании металлов в присутствии кислорода.
Прежде всего, взаимодействие щелочноземельных металлов с кислородом приводит к образованию оксидов. Например, бериллий реагирует с кислородом, образуя двуокись бериллия (BeO), которая является твердым, белым порошком. Магний образует оксид магния (MgO), кальций - оксид кальция (CaO), стронций - оксид стронция (SrO), барий - оксид бария (BaO), а радий - радиевый оксид (RaO).
Взаимодействие щелочноземельных металлов с кислородом также может привести к образованию пероксидов и супероксидов. Например, магний может образовывать пероксид магния (MgO2) и супероксид магния (MgO2), в зависимости от условий реакции.
Оксиды, пероксиды и супероксиды щелочноземельных металлов обладают различными свойствами. Например, оксиды являются щелочными оксидами, которые растворяются в воде, образуя основания. Пероксиды и супероксиды щелочноземельных металлов обладают оксидационными свойствами и могут реагировать с веществами, содержащими двойные или тройные связи.
Взаимодействие щелочноземельных металлов с другими элементами
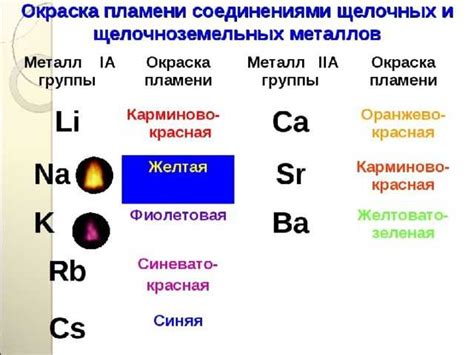
Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают особыми свойствами, которые приводят к их активному взаимодействию с другими элементами. Эти металлы характеризуются высокой химической реактивностью и способностью образовывать ионы положительного заряда.
Одним из наиболее распространенных способов взаимодействия щелочноземельных металлов с другими элементами является образование соединений. Эти металлы активно реагируют с кислородом, образуя оксиды. Например, магний соединяется с кислородом и образует оксид магния (MgO), который обладает высокой температурной стабильностью.
Кроме оксидов, щелочноземельные металлы могут образовывать соединения с другими элементами, такими как водород, сера и фосфор. Например, кальций реагирует с водородом и образует гидрид кальция (CaH2). Этот соединение обладает способностью выделяться в виде гидрогена при контакте с водой.
Взаимодействие щелочноземельных металлов с другими элементами также может происходить в форме образования солей. Эти металлы образуют ионы положительного заряда, которые могут соединяться с отрицательно заряженными анионами, образуя стабильные соединения. Например, барий может соединяться с серой и образовывать сульфат бария (BaSO4), который используется в медицине и промышленности.
Таким образом, взаимодействие щелочноземельных металлов с другими элементами происходит в различных формах, включая образование оксидов, соединений с водородом, серой и фосфором, а также образование солей. Эти процессы обусловлены химическими свойствами щелочноземельных металлов и играют важную роль во многих областях науки и технологии.
Взаимодействие щелочноземельных металлов с водой

Щелочноземельные металлы представляют собой группу элементов, которые характеризуются высокой активностью и реактивностью в химических реакциях. Одной из основных реакций, в которой проявляется их активность, является их взаимодействие с водой.
Вода взаимодействует с щелочноземельными металлами, такими как бериллий, магний, кальций, стронций, барий и радий. В результате этого взаимодействия образуется гидроксид металла и выделяется водород. Это химическое уравнение можно записать следующим образом:
М + 2H2O → М(ОН)2 + H2,
где М обозначает щелочноземельный металл.
Реакция между щелочноземельным металлом и водой протекает довольно быстро и сопровождается выделением водорода в виде пузырьков. Гидроксид металла, образующийся в результате реакции, является щелочным соединением, что объясняет название этой группы элементов.
Щелочноземельные металлы имеют большую электроотрицательность по сравнению с водородом, поэтому они способны вытеснять его из воды. При взаимодействии сильных окислителей или сильных кислот вода может разлагаться на водород и кислород, что потенциально опасно.
Вопрос-ответ

Какие свойства имеют щелочноземельные металлы?
Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают рядом общих свойств. Во-первых, они обладают низкой плотностью и низкой температурой плавления и кипения. Во-вторых, они являются хорошими проводниками тепла и электричества. Кроме того, щелочноземельные металлы очень реактивны и образуют ионно-ковалентные соединения с другими элементами.
Какие соединения образуют щелочноземельные металлы с другими элементами?
Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, образуют соединения с различными элементами. Например, они реагируют с кислотами, образуя соли. Они также образуют соединения с не-металлами, такими как кислород и сера. Соединения щелочноземельных металлов также могут быть использованы в различных промышленных процессах, таких как производство стекла и металлургия.
