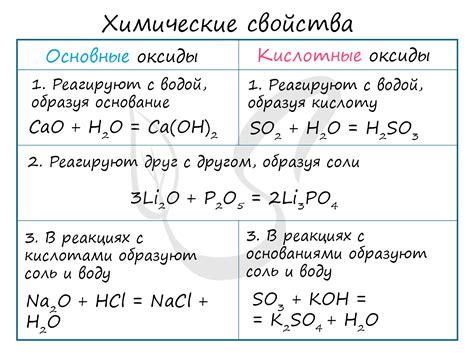
Несолеобразующие металлы — это широкий класс химических элементов, которые не образуют соли при взаимодействии с различными веществами. В отличие от солеобразующих металлов, которые легко реагируют с кислотами или щелочами, несолеобразующие металлы проявляют другие интересные свойства при контакте с различными субстанциями.
Одним из наиболее известных несолеобразующих металлов является алюминий. При контакте с водой он образует оксид алюминия, защищающий его поверхность от дальнейшего окисления. Он также реагирует с кислотами, выделяя водород и образуя соответствующие соли. Алюминий также обладает способностью образовывать сплавы с другими металлами, что делает его важным материалом для производства различных сплавов и конструкций.
Другим примером несолеобразующего металла является железо. Оно может реагировать с кислородом воздуха, образуя оксиды железа, которые приводят к коррозии металла. Железо также обладает магнитными свойствами и может реагировать с серной кислотой, выделяя сероводород и образуя сульфаты железа. Это делает его важным элементом для производства стали и других металлических изделий.
Несолеобразующие металлы являются важными компонентами множества промышленных процессов и материалов. Их уникальные свойства при контакте с различными веществами позволяют использовать их в различных областях науки и технологии.
В данной статье мы рассмотрим более подробно реакции несолеобразующих металлов, их применение в промышленности и повседневной жизни, а также роль, которую они играют в различных химических процессах.
Реакции несолеобразующих металлов
Несолеобразующие металлы - это металлы, которые не образуют соли в реакциях с кислотами. Они могут проявлять различные реакции при контакте с разными веществами.
Один из наиболее известных несолеобразующих металлов - это алюминий. При контакте с кислотами алюминий образует с ними водород и соответствующие соли, но не всегда в виде прямой реакции. Например, при контакте с концентрированной серной кислотой алюминий образует тонкую пленку оксида, которая также защищает металл от дальнейшего взаимодействия.
Еще одним примером несолеобразующего металла является медь. При контакте с кислородом медь окисляется и образует слой оксида на поверхности металла. Этот слой служит защитой от дальнейшей окислительной реакции.
Некоторые несолеобразующие металлы могут реагировать с водой. Например, калий и натрий при контакте с водой проявляют сильную реакцию, при которой выделяется водород и образуются щелочные гидроксиды.
Также некоторые несолеобразующие металлы могут проявлять реакцию с кислородом. Например, железо, подвергнутое окислению, образует ржавчину. Алюминий, который обладает антикоррозийными свойствами, не подвергается окислению воздухом и сохраняет свой металлический блеск.
Таким образом, реакции несолеобразующих металлов взаимодействия с разными веществами могут быть разнообразными и зависят от конкретного металла и условий реакции.
Взаимодействие с кислородом
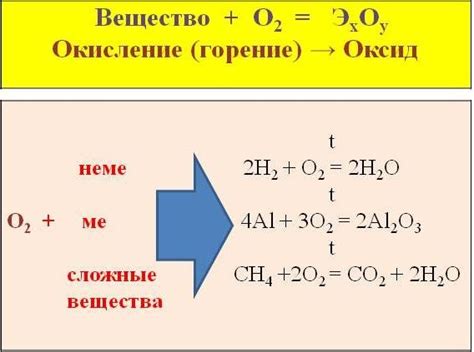
Несолеобразующие металлы, такие как железо, алюминий, цинк и другие, обладают способностью реагировать с кислородом воздуха. При контакте с кислородом они образуют оксиды, которые имеют различные свойства и применения.
Одним из наиболее известных примеров взаимодействия металлов с кислородом является окисление железа, которое приводит к образованию ржавчины. При этом железо реагирует с кислородом и влагой воздуха, образуя гидроксид железа и оксид железа(III). Ржавчина имеет характерный красно-коричневый цвет и хрупкую структуру.
Алюминий также активно взаимодействует с кислородом, образуя тонкую пленку оксида алюминия на его поверхности. Эта пленка является химически стабильной и предотвращает дальнейшее окисление металла. Таким образом, алюминий обладает повышенной стойкостью к коррозии и находит широкое применение в производстве различных изделий.
Цинк также способен взаимодействовать с кислородом, образуя оксид цинка. Этот соединение обладает высокой стабильностью и используется в качестве защитного покрытия для изделий из металла. Оксид цинка образует тонкую пленку, которая предотвращает дальнейшее окисление и коррозию металла.
Реакции с водой

Многие несолеобразующие металлы проявляют реакции с водой при их контакте.
Алюминий, например, при взаимодействии с водой образует оксид алюминия (Al2O3) и водород (H2). Реакция протекает с выделением тепла, поэтому контакт между алюминием и водой может привести к его нагреванию или даже зажиганию, особенно если воды достаточно.
Магний также реагирует с водой, образуя гидроксид магния (Mg(OH)2) и водород. Эта реакция происходит с выделением тепла, поэтому также может привести к жжению или зажиганию магния.
Цинк при контакте с водой образует гидроксид цинка (Zn(OH)2) и водород. Реакция между цинком и водой протекает медленно, но все же может наблюдаться выделение газа.
Большинство несолеобразующих металлов также реагируют с горячей водой, особенно при возможном образовании оксидов или гидроксидов. Реакция с горячей водой может быть более интенсивной и быстрой, поэтому требуется осторожность при отработке таких экспериментов.
Воздействие кислот

Когда несолеобразующий металл вступает в контакт с кислотами, происходит химическая реакция, которая может привести к различным результатам в зависимости от вида кислоты и металла.
Некоторые металлы, такие как железо и цинк, реагируют с сильными кислотами, например соляной или серной, образуя соли и выделяя водород. Эта реакция сопровождается пузырьками газа и выделением тепла.
Другие металлы, например алюминий и магний, образуют защитную пленку оксида на своей поверхности при контакте с кислотой, что препятствует дальнейшему реагированию металла с кислотой. Эта пленка не разрушается, благодаря чему металл сохраняет свою структуру.
Некоторые кислоты, такие как азотная или фосфорная, могут реагировать с металлами, образуя соединения, которые окрашивают вещество в яркие цвета. Например, медь при контакте с азотной кислотой окрашивается в синий или зеленый цвет.
В ряде случаев, реакция между металлом и кислотой может протекать очень быстро и сопровождаться выделением большого количества тепла, что может вызвать опасность. Поэтому важно соблюдать меры предосторожности при работе с кислотами и металлами.
Образование соединений с щелочами

Несолеобразующие металлы при контакте с щелочами, такими как гидроксиды щелочных металлов (например, натрия или калия), образуют соединения, называемые гидроксидами.
При взаимодействии металла с гидроксидами щелочных металлов происходит обмен ионами. В результате образуются гидроксидные ионы, которые растворяются в воде, образуя щелочные растворы.
Образование соединений с щелочами происходит в соответствии с реакцией:
Металл + щелочь → гидроксид металла
Например, реакция алюминия с гидроксидом натрия:
| Вещества | Уравнение реакции |
|---|---|
| Алюминий (Al) | 2 Al + 6 NaOH → 2 Na3AlO3 + 3 H2O |
| Гидроксид натрия (NaOH) | |
| Гидроксид алюминия (Na3AlO3) | |
| Вода (H2O) |
Гидроксиды, образованные в результате взаимодействия металлов с щелочами, широко используются в промышленности, медицине и быту. Они являются основными веществами многих средств по уходу за кожей, а также служат основанием для получения других химических соединений.
Реакция с неорганическими веществами

Несолеобразующие металлы имеют способность образовывать реакции с различными неорганическими веществами. Эти реакции могут быть различными по своему характеру и результатам.
Серная кислота является одним из наиболее распространенных неорганических веществ, с которыми могут взаимодействовать несолеобразующие металлы. Реакция между серной кислотой и металлом может приводить к выделению газа в виде пузырей, а также к образованию солей и воды.
Кислота азотной и фосфорной также могут вызывать аналогичные реакции с несолеобразующими металлами. При взаимодействии с этими кислотами могут образовываться соответствующие соли и выделяться соответствующие газы.
Неорганические вещества, содержащие кислород, такие как нитраты и оксиды, также могут вызывать реакцию с несолеобразующими металлами. В результате этой реакции могут образовываться соли и вода.
Луги, такие как гидроксид натрия или калия, могут вызывать реакцию с несолеобразующими металлами. При этом может происходить образование гидроксидов металлов и выделение соответствующих газов.
Температура также может играть роль в реакциях несолеобразующих металлов с неорганическими веществами. При повышении температуры, реакции между металлом и веществами могут протекать быстрее и более интенсивно.
Вопрос-ответ

Какие реакции могут происходить с несолеобразующими металлами?
Несолеобразующие металлы могут реагировать с различными веществами, включая кислоты, щелочи, газы и другие соединения. Некоторые из этих реакций могут привести к образованию солей, в то время как другие могут вызвать окисление металла или выделение газа. Все зависит от конкретного металла и вещества, с которым он контактирует.
Какие металлы не являются солеобразующими?
К несолеобразующим металлам относятся, например, ртуть (Hg), алюминий (Al) и цинк (Zn). Эти металлы не реагируют с кислотами или щелочами, как делают солеобразующие металлы, и поэтому они обладают другими химическими свойствами.
Что происходит, когда несолеобразующие металлы реагируют с кислотами?
При контакте несолеобразующих металлов, таких как алюминий (Al) или цинк (Zn), с кислотами происходит реакция окисления. В результате этой реакции металл окисляется, а кислота восстанавливается. Образующийся продукт реакции зависит от конкретного металла и кислоты, но в большинстве случаев выделяется водородный газ.
Могут ли несолеобразующие металлы реагировать с безводными веществами?
Да, некоторые несолеобразующие металлы могут реагировать с безводными веществами, такими как хлор, бром или йод. Например, алюминий может реагировать с хлором и бромом, образуя соответствующие хлориды и бромиды металла.
