Щелочные металлы – это элементы главной группы периодической системы, которые включают литий, натрий, калий, рубидий, цезий и франций. Они характеризуются низкой электронегативностью и высокой реакционной способностью.
Одной из важнейших характеристик щелочных металлов является их способность образовывать соединения с положительной степенью окисления. Степень окисления – это числовое значение, отражающее распределение электронов в химической связи. У щелочных металлов степень окисления составляет +1, что свидетельствует о потере одного электрона при вступлении в химическую реакцию.
Проявление степени окисления щелочных металлов является следствием их электроотрицательности и свойством потери электронов. Это означает, что данные элементы имеют тенденцию вступать в химические реакции с элементами, обладающими более высокой электроотрицательностью и способствовать образованию ионов с положительной степенью окисления.
Знание степени окисления щелочных металлов позволяет предсказывать их активность в химических реакциях и определять химические свойства соединений, которые они образуют. Это имеет практическое значение для различных областей науки и промышленности, включая фармацевтику, материаловедение, энергетику и другие.
Щелочные металлы: общее представление
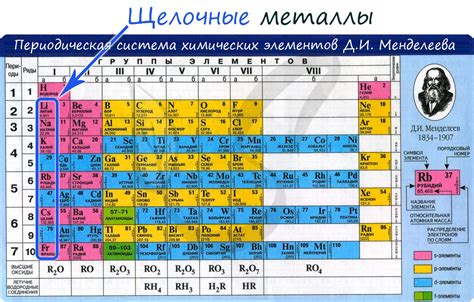
Щелочные металлы – это элементы, которые относятся к первой группе периодической системы химических элементов. В данную группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают низкой температурой плавления, электропроводностью и реакционной способностью.
Щелочные металлы характеризуются наличием одного электрона на внешней энергетической оболочке. В результате это делает их химически активными и подверженными окислению. Они образуют ионы с положительным зарядом, обеспечивая высокую реакционную активность.
Металлы этой группы препятствуют распаду веществ, хранению препаратов в емкостях из стекла или керамики. В контакте с водой они образуют щелочные растворы, которые обладают косметическими и медицинскими свойствами.
Помимо этого, щелочные металлы используются в различных областях, включая производство батареек, сплавов, стекол, жидких электролитов, фосфоритов и др. Их соединения применяются в медицине, пищевой промышленности, сельском хозяйстве и других отраслях.
Химические свойства щелочных металлов

Щелочные металлы - это элементы I группы периодической системы, включающие в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом характерных химических свойств, связанных с их низкой электроотрицательностью и активностью.
Одним из основных химических свойств щелочных металлов является их способность реагировать с водой, образуя щелочные растворы. При контакте с водой щелочные металлы образуют гидроксиды, например, литий реагирует с водой в результате образования гидроксида лития (LiOH) и выделения водорода (H2):
2 Li + 2 H2O → 2 LiOH + H2
Другим важным свойством щелочных металлов является их способность к окислительной реакции с кислородом. Например, натрий сгорает на воздухе, образуя оксид натрия (Na2O):
4 Na + O2 → 2 Na2O
Щелочные металлы также реагируют с неокисленными неметаллами, образуя соли. Например, реакция калия с хлором приводит к образованию хлорида калия:
2 K + Cl2 → 2 KCl
Кроме того, щелочные металлы обладают высокой проводимостью электричества и теплоты, что делает их полезными в различных промышленных и технических приложениях. Они также широко используются в производстве щелочных батарей и в других электрохимических процессах.
Степень окисления в химических соединениях щелочных металлов
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), обладают особенными свойствами, включая способность образовывать различные химические соединения. Одним из важных аспектов при изучении этих соединений является их степень окисления, которая характеризует, сколько электронов металл отдал или принял при образовании данного соединения.
Степень окисления щелочных металлов может быть определена по их положению в периодической системе элементов. Так, литий, находящийся в первой группе, имеет степень окисления +1 в своих соединениях. Натрий, расположенный во второй группе, имеет степень окисления +1, а калий, рубидий и цезий имеют степень окисления +1 в большинстве своих соединений.
Однако щелочные металлы также могут образовывать соединения, в которых степень окисления отличается от +1. Например, пероксид натрия (Na2O2) имеет степень окисления -1 для каждого атома кислорода. Подобные соединения возникают из-за наличия дополнительных электронов, которые металл может принять.
Понимание степени окисления щелочных металлов в их химических соединениях является важным для понимания их свойств и реактивности. Знание степени окисления помогает предсказывать возможные реакции и взаимодействия с другими веществами.
Проявления степени окисления

Степень окисления – это числовое значение, которое показывает, сколько электронов перешло с атома одного химического элемента на атом другого элемента в химической реакции. Для щелочных металлов, таких как литий, натрий и калий, степень окисления обычно равна +1.
Проявление степени окисления щелочных металлов проявляется во многих аспектах и явлениях. Одним из них является способность щелочных металлов образовывать ионы положительного заряда. Это значит, что щелочные металлы готовы отдать один электрон для образования иона, имеющего положительный заряд.
Еще одним проявлением степени окисления щелочных металлов является их способность реагировать с водой. Литий, натрий и калий очень реактивны и быстро реагируют с водой, образуя ионы гидроксида и выделяя водород. Этот процесс можно представить следующей химической реакцией:
- 2Li + 2H₂O → 2LiOH + H₂
- 2Na + 2H₂O → 2NaOH + H₂
- 2K + 2H₂O → 2KOH + H₂
Степень окисления щелочных металлов также проявляется в их реакции с кислородом. Литий, натрий и калий способны гореть на воздухе, образуя оксиды соответствующих металлов:
- 4Li + O₂ → 2Li₂O
- 4Na + O₂ → 2Na₂O
- 4K + O₂ → 2K₂O
Таким образом, щелочные металлы имеют свои уникальные проявления степени окисления, которые определяют их химические свойства и реактивность.
Роль степени окисления в реакциях щелочных металлов

Степень окисления играет важную роль в химических реакциях щелочных металлов, таких как литий, натрий, калий и другие. Степень окисления указывает на количество электронов, которые щелочный металл отдает или принимает во время реакции. Она влияет на те свойства и возможности, которые проявляет металл в различных химических процессах.
В реакциях с другими веществами щелочные металлы могут проявлять разные степени окисления. Например, натрий может иметь степень окисления +1 в соединениях с кислородом, таких как оксид натрия (Na2O), а воду (NaOH) растворет и переходит в ион Na+, имеющий степень окисления +1. Калий может иметь как +1, так и +2 степени окисления в разных соединениях.
Степень окисления щелочных металлов также влияет на их активность в реакциях. Более высокая степень окисления может указывать на большую активность и более легкую возможность вступления в химические реакции. На основе степени окисления можно предсказать, какие продукты реакции могут образовываться и как металл будет взаимодействовать с другими веществами.
Изменение степени окисления также может быть связано с изменением валентности щелочного металла. Например, при окислении натрия с +1 до +2 степени окисления, его валентность также изменяется с +1 до +2. Изменения валентности и степени окисления щелочных металлов играют важную роль в их химической активности и соединительной способности.
Изменение степени окисления в разных условиях
Щелочные металлы, такие как литий, натрий и калий, могут проявлять разные степени окисления в различных условиях. Степень окисления - это число, которое отражает количество электронов, переданных атомом данного элемента при образовании соединения. Она может изменяться в зависимости от окружающей среды и других факторов.
В некоторых условиях, щелочные металлы проявляют степень окисления +1. Например, в простых окислителях, таких как кислород или фтор, щелочные металлы отдают один электрон и образуют соединения с положительным зарядом. Примером такого соединения является лития оксид (Li2O), где литий имеет степень окисления +1.
Однако, в некоторых других условиях, щелочные металлы могут проявлять и более высокие степени окисления. Например, в соединениях с кислородом высокой валентности, как в пероксидах или супероксидах, металл может иметь степень окисления +2 или даже +3. Например, натрий пероксид (Na2O2) содержит натрий со степенью окисления +2, а калий супероксид (KO2) содержит калий со степенью окисления +1.
Другие факторы, такие как наличие других элементов или различных ионов в реакциях, также могут влиять на степень окисления щелочных металлов. Например, в соединении натрия с алюминием (NaAl), натрий имеет степень окисления +1, а алюминий -3. Это связано с тем, что алюминий образует трехвалентные ионы, а натрий - одновалентные.
Важность определения степени окисления для практического применения

Различение и определение степени окисления щелочных металлов является важным аспектом для их практического применения в различных сферах. Степень окисления указывает на количество электронов, которые металл отдал или принял при образовании соответствующего иона. Она может быть положительной или отрицательной величиной и служит ключевым фактором в реакциях с другими веществами.
Определение степени окисления широко используется в химической промышленности при производстве различных веществ и материалов. Например, при производстве стекла щелочные металлы играют важную роль, и знание их степени окисления позволяет контролировать качество и свойства итогового продукта. Также, при создании сплавов и композитных материалов, знание степени окисления помогает оптимизировать их свойства, в том числе прочность, термическую стойкость и электропроводность.
В медицине степень окисления щелочных металлов может иметь важное значение при создании лекарственных препаратов. Некоторые соединения, содержащие эти металлы, проявляют уникальные свойства, способствующие их поглощению и транспортировке в организме. Определение степени окисления помогает установить оптимальную форму ионов для достижения желаемого эффекта и минимизации побочных действий.
Знание степени окисления щелочных металлов также играет важную роль в экологии и охране окружающей среды. Они широко применяются в процессах очистки воды и сточных вод, благодаря своим уникальным свойствам и возможности изменения своей степени окисления в реакциях окислительно-восстановительного характера.
Вопрос-ответ

Что такое щелочные металлы и как они проявляют степень окисления?
Щелочные металлы - это элементы первой группы периодической системы, такие как литий, натрий, калий и др. Они проявляют свою степень окисления путем снятия одного электрона из своей последней энергетической оболочки. Это делает их крайне реактивными и способными образовывать положительные ионы.
Какие свойства щелочных металлов определяют их способность проявлять степень окисления?
Одно из главных свойств щелочных металлов, которое определяет их способность проявлять степень окисления, это низкая энергия ионизации. Это означает, что энергия, необходимая для удаления электрона из внешней оболочки атома металла, очень низкая. Из-за этого щелочные металлы легко теряют один электрон и образуют положительные ионы с единичной степенью окисления.
Какие ионы образуются при окислении щелочных металлов?
При окислении щелочных металлов образуются положительные ионы с единичной степенью окисления. Например, литий образует ион Li+, натрий образует ион Na+, а калий - ион K+.
Какие еще элементы могут проявлять степень окисления и почему?
В дополнение к щелочным металлам, степень окисления могут проявлять и другие элементы с низкой энергией ионизации, такие как щелочноземельные металлы (например, магний, кальций), а также алюминий и бериллий. Это связано с тем, что все эти элементы имеют низкую энергию ионизации, что облегчает потерю электронов из внешней оболочки.
