Атомы одного элемента металла - это микрочастицы, состоящие из ядра и электронной оболочки. Ядро содержит протоны и нейтроны, образуя положительно заряженное ядро. Электронная оболочка окружает ядро и содержит отрицательно заряженные электроны.
Атомы одного элемента металла характеризуются высокой проводимостью электричества и тепла, а также своеобразной структурой кристаллической решетки. Металлы обладают гибкостью и пластичностью, что означает, что атомы металла могут легко менять свою позицию в кристаллической решетке без разрушения ее структуры.
Помимо своих физических свойств, атомы металлов также играют важную роль в химических реакциях и образовании различных соединений. Они могут обмениваться электронами с другими атомами, образуя ионные соединения или общаясь с другими атомами металла, образуя металлические соединения. Эти химические свойства атомов металла являются основой для широкого применения металлов в различных отраслях промышленности и технологий.
Структура атомов
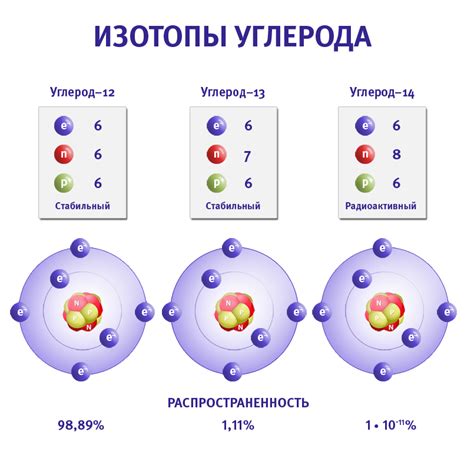
Атомы - это основные строительные элементы материи. Они состоят из трех основных частей: протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, в то время как электроны движутся по орбитам вокруг ядра.
Протоны - это положительно заряженные частицы, которые содержатся в ядре атома. Они имеют массу, равную примерно 1 атомной единице и обозначаются символом "p+". Количество протонов определяет атомный номер элемента и его положение в периодической таблице.
Нейтроны - это нейтральные (незаряженные) частицы, которые также находятся в ядре атома. Они имеют массу, сходную с массой протона и обозначаются символом "n". Количество нейтронов в атоме может варьироваться, создавая изотопы данного элемента.
Электроны - это отрицательно заряженные частицы, которые движутся по множеству энергетических уровней или орбит вокруг ядра атома. Они имеют очень маленькую массу и обозначаются символом "e-". Электроны определяют химические свойства атома и могут быть переданы или приняты другими атомами во время химических реакций.
Структура атомов может быть представлена в виде электронной оболочки, состоящей из нескольких энергетических уровней и орбит. На каждом уровне может находиться определенное количество электронов. Внутренний уровень может содержать до 2 электронов, второй уровень - до 8 электронов, а третий уровень - до 18 электронов. Количество электронов во внешней оболочке определяет химическую реактивность атома.
Кратко говоря, структура атомов является фундаментальным элементом, определяющим свойства и поведение различных элементов в химических реакциях. Понимание структуры атомов позволяет проводить исследования в области химии, физики и других наук, а также разрабатывать новые материалы и технологии.
Состав атомов металла

Атомы металлов являются основными строительными блоками всех металлических материалов. Они представлены в периодической таблице элементов, где каждый металл имеет свой собственный атомный номер и символ.
Состав атомов металла определяется его электронной структурой. Атом металла состоит из ядра, в котором содержатся протоны и нейтроны, и облака электронов, которые обращаются вокруг ядра по определенным энергетическим орбитам.
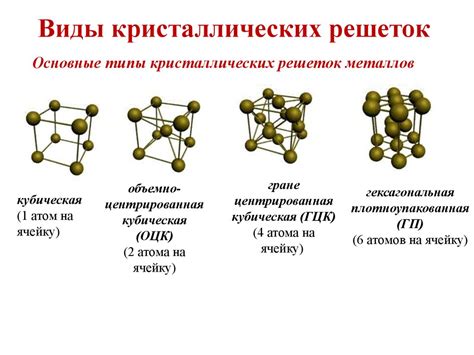
Атомы металла обычно имеют большой размер и сильное металлическое связывание, что делает их устойчивыми и способными к образованию кристаллической решетки. Кристаллическая решетка состоит из регулярно расположенных атомов металла, которые образуют трехмерные структуры.
Состав атомов металла также определяет их химические свойства. Атомы металлов обладают свободными электронами, которые способны образовывать связи с другими атомами, образуя ионные или ковалентные связи. Эти связи позволяют металлам образовывать различные соединения и проявлять разнообразные физические и химические свойства.
Особенности атомов металла
Атомы металла являются основными строительными блоками металлических материалов и обладают рядом характерных особенностей.
1. Электронная структура: Атомы металла имеют небольшое количество электронов в валентной оболочке, что делает их склонными к потере электронов. Это позволяет ионизированным атомам образовывать положительные ионы.
2. Металлическая связь: Атомы металла образуют кристаллическую решетку, где положительно заряженные ионы окружены облаком свободных электронов. Это обеспечивает высокую проводимость электричества и тепла в металлах.
3. Металлический блеск: Атомы металла обладают способностью поглощать и переизлучать свет, что придает металлам характерный блеск. Это свойство связано с наличием свободных электронов, которые отвечают за поглощение и излучение световых волн.
4. Пластичность: Атомы металла обладают высокой пластичностью, то есть способностью менять свою форму без разрушения кристаллической структуры. Это свойство обусловлено подвижностью ионо-электронного облака в металлической решетке.
5. Поверхностная оксидация: Атомы металла могут образовывать оксидную пленку на своей поверхности в результате реакции с кислородом воздуха. Эта пленка препятствует дальнейшей коррозии металла и служит защитой от окружающей среды.
Таким образом, атомы металла обладают уникальными свойствами, которые делают металлы важными и широко используемыми материалами в различных областях нашей жизни.
Вопрос-ответ

Какова особенность атомов одного элемента металла?
Особенностью атомов одного элемента металла является их однородность и одинаковый состав. Все атомы одного элемента металла имеют одинаковое количество протонов и электронов, что делает их структурно схожими.
Какие свойства обладают атомы одного элемента металла?
Атомы одного элемента металла обладают такими свойствами, как высокая проводимость электричества и тепла, пластичность, малая твердость и высокая плотность. Эти свойства являются основными характеристиками металлов и определяют их способность к образованию металлической структуры и хорошей проводимости электричества.
